对于某些离子的检验及结论中一定正确的是( )
| A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- |
| C.分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
实验室制Cl2的反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1mol Cl2,转移电子的物质的量为2mol |
| C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol |
| D.转移电子的物质的量为1mol时,生成在标准状况下Cl2的体积为11.2 L |
下列关于硅材料的说法正确的是
| A.玛瑙的主要成分是硅酸盐 |
| B.制普通玻璃的原料是石灰石、纯碱和石英砂 |
| C.光导纤维的主要成分是晶体硅 |
| D.水晶项链、玻璃、水泥和陶瓷都是硅酸盐制品 |
下列各组离子在水溶液能大量共存的是
| A.Cu2+、K+、OH-、SO42- | B.Na+、Ca2+、NO3-、Cl- |
| C.NH4+、Al3+、AlO2-、H+ | D.SO32-、Ba2+、H+、NO3- |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.将0.1molFeCl3溶液于1L水中,所得溶液含Fe3+离子数目为0.1NA |
| B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA |
| C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA |
| D.在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA |
对下列物品标签的分析不正确的是
| 选项 |
A |
B |
C |
D |
| 物品标签 |
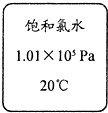 |
药品:××× |
 |
 |
| 分析 |
该试剂应该装在橡胶塞的细口瓶中 |
该药品不能与皮肤直接接触 |
该物质受热易分解 |
该物质浓度为18.4mol/L |