某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO ,则下列推断正确的是 ( )。
,则下列推断正确的是 ( )。
| A.负极反应为H2+2OH--2e-===2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
下列物质中分子间能形成氢键的是
| A.N2 | B.HBr | C.NH3 | D.H2S |
下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al | D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
| A.CuS易水解 |
| B.CuS可溶于盐酸 |
| C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大 |
| D.强酸可以制取弱酸 |
溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是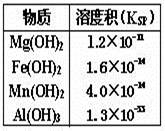
| A.Al3+最先转化为Al(OH)3沉淀 |
| B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀 |
| C.要使Mg2+转化为沉淀,溶液pH应大于9 |
| D.pH=14时,四种金属离子全部以沉淀形式存在 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应