金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2 + bCl2+eC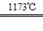 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg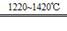 Ti+2MgCl2 Ⅱ
Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b="e" =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤
A.N2(g) +3H2(g) 2NH3(g)△H=—Q1kJ·mol—1(Q1>0) 2NH3(g)△H=—Q1kJ·mol—1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)△H=+Q2kJ·mol—1(Q2>0) 2SO2(g)+O2(g)△H=+Q2kJ·mol—1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-Q3kJ·mol—1(Q3>0) 4NO(g)+6H2O(g)△H=-Q3kJ·mol—1(Q3>0) |
D.H2(g) +CO(g) C(s)+H2O(g)△H=+Q4kJ·mol—1(Q4>0) C(s)+H2O(g)△H=+Q4kJ·mol—1(Q4>0) |
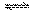
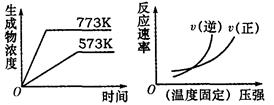
| A.增大了X或Y的浓度 |
| B.使用了催化剂 |
| C.增大了体系压强 |
| D.升高了该反应的温度 |
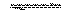
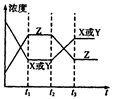
6 mol、2 mol、6 mol。在保持温度和压强不变的情况下,下列说法正确的是( )
A.将A、B、C各减少1 mol,C的百分含量减少
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.充入1 mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
D.加入一定量的A气体达平衡后,C的百分含量一定增加
| A.将块状碳酸钙固体换成粉末状固体 | B.盐酸的量增加一倍 |
| C.盐酸的用量减半浓度加倍 | D.温度升高40 0C |

其中,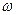 (W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
| A.图I可能是不同压强对反应的影响,且P2>P1,a+b<n |
B.图III可能是不同温度对反应的影响,且T1>T2,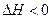 |
| C.图II可能是不同压强对反应的影响,且P1>P2,n<a+b |
| D.图II可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |