工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备:2FeC2O4·2H2O + H2O2+ 3K2C2O4+ H2C2O4=2K3[Fe(C2O4)3]·3H2O
(1)[Fe(C2O4)3]3-的名称是_______________。
(2)制备过程要防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式__________。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3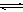 [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为: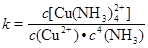 。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
(4)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂。经组成分析A仅含K、Fe、C、N四种元素。取36.8g A加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍,Fe3C物质的量是氮气物质的量的1/3。则A的化学式为____________________。
某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)如果实验室有10mL、15mL、50mL量筒,最好应选用 mL的量筒来量取所需的98%的浓硫酸的体积 mL。
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到仪器A中(仪器A的名称为 )
③将浓硫酸缓缓注入盛有适量仪蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向仪器A中加入蒸馏水,在距离刻度1-2cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2-3次,洗涤液也注入仪器A中,轻轻摇动仪器A,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填写序号)
(4)下列操作会引起所配溶液浓度偏大的是 (填写字母)
A.量筒用蒸馏水洗涤后未干燥即用来冷却浓硫酸
B.容量瓶用蒸馏水洗净后未干燥即用来配制溶液
C.定容时,观察液面俯视刻度线
E.取用浓硫酸后,将量筒用蒸馏水洗涤并将洗涤液转移容量瓶中
F.摇匀后,液面低于刻度线,没有再加蒸馏水
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下来实验常用到的仪器回答问题:
(1)填写以下仪器的名称:B D E G 。
(2)用四氯化碳提取出溴水中Br2单质的方法叫做: ,将Br2的四氯化碳溶液和水分离开的操作叫做: ,下列是进行该操作的步骤,正确的是顺序是: 。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
(3)已知Br2的沸点是58.5°C,四氯化碳沸点是78°C。将Br2的四氯化碳溶液分离开的方法是 。需要用到的玻璃仪器有(填字母) 。
(原创)重庆一中某化学兴趣小组,欲在常温常压下,用一定质量的铜镁合金与足量稀盐酸反应,利用下图装置,测定样品中铜的质量分数。
A B C
(1)实验反应原理:写出镁与稀盐酸发生反应的化学方程式________________
(2)仪器识别:写出上图中仪器①、②的名称:①_________②__________
(3)装置连接:a→___________→___________→d
(4)A中反应已经进行完毕的现象为__________________________
(5)实验中,该兴趣小组同学测得以下数据
a.反应前样品铜镁合金的质量,记为m1 g
b.反应结束后,经过处理后的残余固体的质量,记为m2 g
c.经过一系列正确的操作后,读取量筒中的水的体积,记为V mL
d.查阅资料,常温常压下,H2的密度为ρ g/L
四位同学分成甲、乙两个小组,甲组同学利用重量法为思路,请合理选择以上数据,列式求铜的质量分数:________×100%;乙组同学利用排水法测量气体体积为思路,请合理选择以上数据,列式求铜的质量分数:________×100%
(6)误差分析环节中指导教师提出,甲、乙两组同学的思路中,会有很多因素导致测得的铜的质量分数出现误差,现将可能导致误差的因素罗列如下,并回答相关问题
a.读取量筒中水的体积时,未等装置中气体恢复至室温
b.读取量筒中水的体积时,俯视量筒
c.实验开始前,没有检查装置气密性,然而装置实际是漏气的
d.B瓶中残留的空气的干扰
e.未除去样品铜镁合金表面的氧化膜便进行称量
f.未对反应中挥发出的HCl气体进行除杂处理
g.未对反应后剩余的残余物进行洗涤
h.未考虑B、C装置间连接导管中残留的水
导致铜的质量分数大于理论值的原因可能是___________________(填符号a~h)
导致铜的质量分数小于理论值的原因可能是___________________(填符号a~h)
(原创)海洋中含有丰富的宝贵资源,除了制备粗盐,还可以提取碘,冶炼金属镁等。
I.海藻中含有丰富的碘元素,碘元素以I﹣的形式存在,Cl2可以将I﹣氧化得到碘单质,实验室从海藻中提取碘单质的实验流程如下:
(1)请写出相关操作的名称:①_____________________;③_______________________
(2)如果要求有色层在上层,可以选择_______________试剂进行碘单质的萃取(填字母)
| A.醋酸 | B.苯 | C.四氯化碳 | D.汽油 |
(3)实验中的“后期处理”主要是指分液和蒸馏,蒸馏采用实验装置如下图所示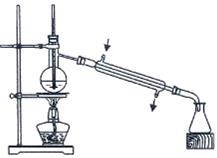
此图中的错误共有_________处(填数字)
II.海水经淡化可获得淡水和浓海水,浓海水中主要含有离子Na+、Mg2+、Cl﹣、SO42﹣。从浓海水中提取金属镁的一般工艺流程如下: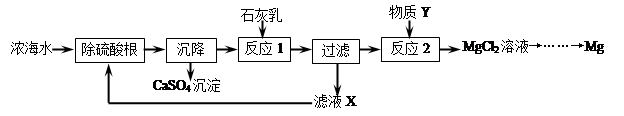
(1)补全由贝壳(主要成分为碳酸钙)生产石灰乳的相应转化中所需的条件或反应物: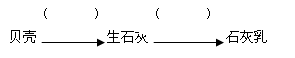
(2)写出反应2的化学方程式: 。
(3)操作流程中可循环使用的滤液X中的物质是 (填化学式)。
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是 ;冷凝管中冷却水从 (填“a”或“b”)口进水。
(2)A中多孔球泡的作用是 。
(3)冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(4)写出步骤2中发生反应的化学方程式 。
(5)步骤3中在真空容器中蒸发浓缩的原因是 。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 。