某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数。
【方法一】测 SO2质量法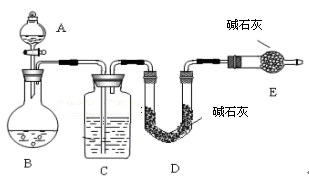
采用如图所示装置,通过实验测定生成SO2的质量。
(1)C中盛放的试剂是 ,E装置的作用是 。
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的。该方法的缺点是(只答一点)
。
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: 。
(4)若m3=2m4则试样中Na2SO4的质量分数为 。
已知:A酸的溶液pH=a,B碱的溶液pH="b"
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=。若酸碱按体积比为1:10混合后溶液显中性,
则a+b=。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol·L-1,B溶液中水电离出的氢离子浓度为。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为。
某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子,有关的离子反应式为。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀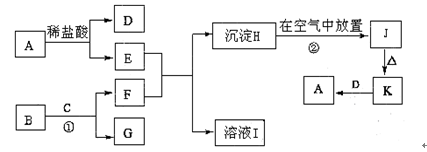
请写出:
(1) A、B的化学式为:A,B。
(2)过程②中的反应现象:。
(3)反应①的化学方程式。
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式。
(2)NO2是一种色的气体,在上述反应中作(填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为。
(3)上述反应中氧化剂与还原剂的物质的量之比为,HNO3在反应中表现出性和性。
(4)若反应中生成1mol的NO2,则反应中转移mol的电子,消耗Cug。
欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去。已知:
 (1)某含铬废水处理的主要流程如图所示:
(1)某含铬废水处理的主要流程如图所示:
①沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理
。
②反应池中发生主要反应的离子方程式是Cr2O2—7+3HSO—3+5H+===2Cr3++3SO2—4+H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是、。证明Cr3+沉淀完全的方法是。
(2)工业亦可用电解法来处理含Cr2O2-7废水。实验室 利用如图模
利用如图模 拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+
拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+ ,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3
,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3 +,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:。
+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:。
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是g。