利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。据此回答: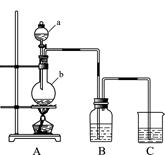
(1)C中的试剂是 ;仪器b的名称为 ,b中发生反应的离子方程式为 。
(2)写出新制饱和氯水中含有氯元素物质的化学式: 。氯水长时间放置,氯水中的成分就会发生变化,能快速判断氯水中含有较多C12的方法是: 。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去。② 。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
【实验步骤】
①取上述实验后试管内的无色溶液3 mL盛于另一支洁净的试管中;② ,振荡试管。
【现象与结论】
①若 ,则证明溶液红色褪去的原因是①而不是②。
②若 ,则证明溶液红色褪去的原因是②而不是①。(5)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是 。
| A.CaCO3 | B.NaHSO3 | C.Na2CO3 | D.Ca(OH)2 |
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白(可能用到的相对原子质量:Al-27)
[探究一] 实验方案: 。
。
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(“偏高”或“偏低”)
[探究二] 实验方案: (实验装置如下图)
(实验装置如下图)
问题讨论:
为使测定结果尽可能精确,实验中应注意的问题是(写出可能的一点):
。
[探究三] 实验方案:称量m g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:欲计算Mg的质量分数,该实验中还需测定的数据是。
[实验拓展] 请你另设计一个实验方案,测定该铝镁合金中镁的质量分数(书写形式可以模仿探究一、二实验方案)。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3— 能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出F e3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。
e3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO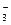 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不 要求写具体操作过程) 要求写具体操作过程) |
预期现象和结论 |
| ① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO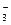 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论_____,并简述理由:(用离子方程式表示)。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
FeCl3溶液含有淀粉的 碘水 NaOH溶液
碘水 NaOH溶液
A B C
(1)SO2气体还原Fe3+的产物是(填离子符号),参加反应的SO2和Fe3+的物质的量之比是。
(2)下列实验方案适用于在实验室制取所需SO2的是(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是。(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是,原因是。
(6)能表明I-的还原性弱于SO2的现象是。
实验室利用图④来制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。请用下列编号为①~④的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气。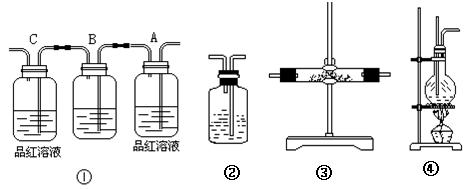
(1)装置③中的固体药品为 ,用以验证的产物是
(2)装置B中的试剂为(填“A、B、C、D”)
A.溴水 B.酸性高锰酸钾溶液 C.NaOH溶液 D.饱和NaHCO3溶液
(3)装置②盛有,可以验证气体的存在。
(4)用装置的编号表示其连接顺序(按气体产物从左到右的流向)④→ ;
;
(5)装置A中的现象是,验证;
(6)装置C中的现象是说明。
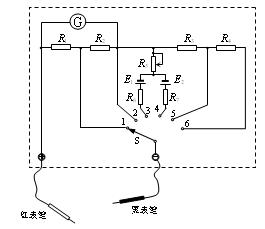
(1).电流传感器可以像电流表一样测量电流,不同的是它的反应非常快,可以捕捉到瞬间的电流变化。此外,由于它与计算机相连,能在几秒钟内画出电流随时间变化的图象。在如图a所示的电路中,电源的电动势为6V,先将电键S与1端相连,稳定后,再将电键S从位置1转换到位置2,电容器便通过电阻R放电,这时,电流传感器将电流信息传入计算机,屏幕上便显示出如图b所示的I-t图象。据此,可以估算出电容器的带电量约为 C,电容器的电容量约为μF。(均取一位有效数字)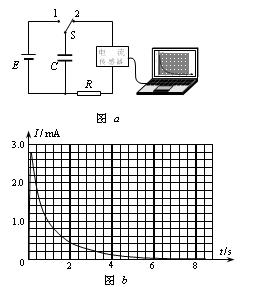
(2)如图为一简易多用表的内部电路原理图,其中G为灵敏电流计,S为单刀多掷电键(功能键),表内两恒压直流电源的电动势不相等,且E1 < E2。由图可知,欲测电压时,应将功能键置于或位置;欲测电阻时,应将功能键置于或位置。在测电流的两个位置中,将功能键置于位置时电流的量程较大;在测电阻的两个位置中,将功能键置于位置时所选的倍率较大。(统一填写功能键序号)