下列说法正确的是( )
| A.有人利用ZrO2作为固体电解质(允许O2-通过)制造出了常温下的甲醇一空气燃料电池。当原电池中有0.5 mol甲醇消耗时,则负极消耗O2—的物质的量为1.5mol |
B.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为 g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml |
C.已知常温下,氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中C(OH-)=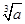 mol/L mol/L |
| D.将11.2g的Mg和Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。 再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是0.2mol NO2和0.1mol N2O4 |
下列实验中操作.现象.结论对应关系正确的一组是
| 选项 |
操作 |
现象 |
结论 |
| A |
在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅 速搅拌 速搅拌 |
蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 |
只体现了浓硫酸的脱水性 |
| B |
淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 |
产生红色沉淀 |
淀粉水解可生成葡萄糖 |
| C |
溴乙烷和氢氧化钠溶液充分反应后,用足量 稀硝酸酸化,再加入硝酸银溶液 稀硝酸酸化,再加入硝酸银溶液 |
生成淡黄色沉淀 |
溴乙烷中含有溴元素 |
| D |
将溴水加入苯中并充分振荡 |
溴水褪色 |
苯与溴发生了取代反应 |
背景新闻:①2009年4月,德国NUK婴儿爽身粉因含致癌物“滑石粉”(Mg3(Si4O10)(OH)2)引起关注。②2010年1月12日海地首都太子港发生7.3级地震,急需大量医药品.食物.饮用水等。③2009年12月下旬,渤海.黄海海域出现严重的海冰灾害。④2009年诺贝尔化学奖成果与蛋白质知识有关。下列说法不正确的是
| A.滑石粉属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO·4SiO2·2H2O |
| B.次氯酸钠.石灰.明矾可作消毒杀菌剂;碳酸钡俗称“钡餐”,是一种医疗药品 |
| C.水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体 |
| D.毛.发等的主要成分都是蛋白质,蛋白质水解的最终产物是氨基酸 |
20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
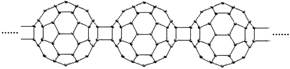
| A.X难溶于水 | B.一定条件下X可与H2发生加成反应 |
| C.X是碳的一种同素异形体 | D.X的摩尔质量为720n |
化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是
A.基态Mg原子的核外电子排布图: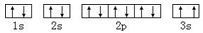 |
B.过氧化氢电子式: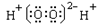 |
| C.As原子的简化电子排布式为:[Ar]4s24p3 |
D.原子核内有10个中子的氧原子: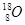 |
下列说法中,不正确的是
| A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都符合绿色化学的思想 |
| B.同位素示踪法是研究化学反应历程的手段之一 |
| C.焰色反应主要是利用了原子光谱中原子吸收光谱 |
| D.比能量是衡量电池优劣的主要标准之一 |