已知丁烷燃烧热△H=" -akJ" /mol ,写出丁烷燃烧热的热化学方程式___ ___________;完全燃烧一定量的丁烷,放出的热量为Q,已知为了完全吸收生成的CO2,消耗掉4mol/L NaOH溶液50mL ,则1mol丁烷完全燃烧放出的热量Q1的范围为______________________________。
将1.92 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到标况下气体1.12 L(设不含N2O4),求:
(1)收集到的气体中主要有含有;
(2)上述过程中,有关反应的化学方程式为;;
(3)反应中被还原的HNO3的物质的量是;
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是多少摩尔?(计算过程)
化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验: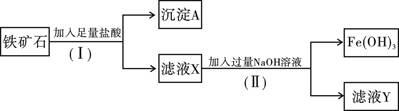
(1)步骤(I)中分离溶液和沉淀的操作名称是;
(2)沉淀A中一定含有,该物质属于氧化物;(填“酸性”或“碱性”)
(3)要检验滤液X中的金属阳离子,应加入;
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式;
(5)溶液Y中溶质的化学式为 。
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用;
(2)若A是一种黄色单质固体,则B→C的化学方程式为;
(3)若A是一种黑色非金属单质固体,写出B的一个用途;
(4)若C是红棕色气体,则A化学式可能为,试写出C与水反应的化学方程式。
某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
25.05 |
25.00 |
23.80 |
24.95 |
则该醋酸溶液的浓度为________________。
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。
①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的倍;
c (OH-) -c (CH3COOH) = mol·L-1。
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g)ΔH = -90.8kJ·mol-1
CH3OH(g)ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH = -23.5kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)ΔH = -41.3kJ·mol-1
CO2(g)+H2(g)ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH =。
CH3OCH3(g)+CO2(g);ΔH =。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
电极a的电极反应式为。