现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol•L-1) |
V/mL |
c/(mol•L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是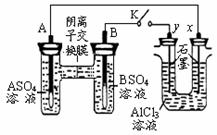
A.金属活动性A强于B
B.B电极反应B-2e-=B2+
C.x电极上有H2产生,发生还原反应
D.反应初期x电极周围出现白色沉淀,继续实验沉淀将溶解
恒温恒容的三个密闭容器,N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
| 容器 编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
A.放出热量a<b<92.4
B.三个容器内反应的平衡常数③>①>②
C.N2的转化率①<②
D.达平衡时氨气的体积分数①>③
下列说法不正确的是
| A.乙醇、乙醛、乙酸都能与H2O形成分子间氢键 |
| B.丙烯中最多有7个原子共平面 |
| C.乙醇与金属钠反应比水与金属钠反应更剧烈,羟基H活性更高 |
D.乙酸、甲酸甲酯和羟基乙醛(如图)互为同分异构体 |
下列有关热化学方程式的叙述正确的是
| A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 |
| B.2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1 |
| C.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1 |
| D.N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
2NO2(g) N2O4(g) ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是
N2O4(g) ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是
| A.a点表示反应处于平衡状态 |
| B.25 min末,若增大压强,化学平衡常数增大 |
| C.25 min末,若升高温度,NO2的体积分数减小 |
| D.10min内用N2O4表示的平均速率为0.02mol·L-1·min-1 |