下列各项内容中,排列顺序正确的是()
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③⑤ | B.①②④ | C.④⑤ | D.①② |
根据原子结构及元素周期律的知识,下列推断正确的是()
| A.同周期元素含氧酸的酸性随核电荷数的增加而增强 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl‾、S2‾、K+、Ca2+半径逐渐减小 |
D.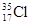 与 与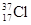 得电子能力相同 得电子能力相同 |
下列说法正确的是()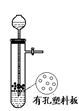


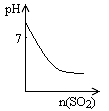
图Ⅰ图Ⅱ图Ⅲ图Ⅳ
| A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体 |
| B.图Ⅱ装置可验证非金属性:Cl>C>Si |
| C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3 |
| D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化 |
有MgCl2和KCl的混合溶液VL,将它均分成两份。一份滴加氨水,使Mg2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(K+) (mol/L)为()
| A.(2b-4a)/V | B.(b-a)/V | C.(2b-2a)/V | D.(b-2a)/V |
用NA表示阿伏加德罗常数的值,下列叙述正确的是()
| A.常温常压下的33. 6L氯气与27g铝充分反应,转移电子数为小于3NA |
| B.0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA |
| C.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
D.5NH4NO3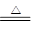 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA |