对下列实验过程的评价,正确的是
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B.某溶液中滴加BaCl2溶液,生成白色沉淀.证明一定含有SO42- |
| C.某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D.验证某溶液中是否含Cl-,先加过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl- |
溶液中可发生以下反应:①16H++10Z +2XO
+2XO =2X
=2X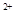 +5Z2+8H2O,②2M
+5Z2+8H2O,②2M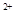 +R2=2M
+R2=2M +2R-,③2R-+Z2=R2+2Z-由此判断下列说法错误的是
+2R-,③2R-+Z2=R2+2Z-由此判断下列说法错误的是
A.氧化性强弱: <Z2 <R2 <M <Z2 <R2 <M |
B.还原性强弱:X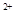 <Z <Z <R <R <M <M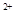 |
| C.Z元素在反应①中被氧化,在③中被还原 |
| D.常温下可发生反应2M2++Z2=2M3++2Z- |
下列离子方程式正确的是
| A.FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.4 mol的Cl2通入含3molFeBr2的溶液中: 2Fe2++6Br-+4Cl2=2Fe3++6Cl-+3Br2 |
| C.漂白粉溶液中通入SO2: Ca2++ 2ClO-+ SO2 + H2O =CaSO3↓+2HClO |
| D.NaHCO3水溶液里电离NaHCO3==Na+ + H+ + CO32- |
用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒②10 mL量筒③50 mL烧杯④托盘天平⑤100 mL容量瓶⑥胶头滴管⑦玻璃棒,按使用仪器的先后顺序排列正确的是
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为
| A.1:1:1 | B.3:2:1 | C.6:3:2 | D.9:3:1 |
将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色.该化合物是下列物质中
| A.Fe2O3 | B.FeCl3 | C.Fe2(SO4)3 | D.FeO |