将下列离子方程式改写成化学方程式:
(1)CO32—+2H+=CO2↑+H2O:
(2)Cu2++2OH—=Cu(OH)2↓:
(3)Zn+2Ag+=Zn2++2Ag:
(1)(6分)已知实验室制备氯气的反应:MnO2 +4HCl(浓)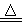 MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
(2)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(3)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2
①该反应中的氧化剂是。
②该反应中,发生还原反应的过程是→。
③写出该反应的化学方程式,并标出电子转移的方向和数目。
④如反应转移了0.6mol电子,则产生的气体在标准状况下体积为。
(6分)现有以下物质①KNO3溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤AgCl固体⑥蔗糖⑦酒精⑧熔融的NaCl⑨氨水⑩盐酸,其中能够导电的是_________________(填序号,下同);属于电解质的是__________________;属于非电解质的是___________________________。
回答下列问题:
(1)下列仪器中:①试管②烧杯③烧瓶④坩埚⑤蒸发皿⑥锥形瓶⑦燃烧匙。可用于直接加热的仪器是________________,需要垫石棉网加热的仪器是____________。(用序号填写)
(2)实验室中需要配制490 mL 0.10 mol·L-1的NaOH溶液。根据题意填空:
A.配制该溶液应选用玻璃仪器有:_________。
B.用托盘天平称取 ________ g NaOH固体。
(3)下列操作导致配制的溶液浓度偏低的是。
A.定容时俯视刻度线
B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
E.定容时超出刻度线,用胶头滴管将溶液吸出到刻度线。
F.移液过程中不小心将溶液溅出
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
根据设计要求回答:
(1)B装置有三种功能:①干燥气体;②________;③________。
(2)设V(Cl2)/V(CH4)=x,若测得通入1molCH4得到四种有机产物物质的量相等,则理论上x值应为________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_____________________________________。
(4)E装置的作用是___________________(填编号)。
| A.收集气体 | B.吸收氯气 | C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4
b.CH3Cl
c.CH2Cl2
d.CHCl3
e.CCl4
甲醇是未来重要的绿色能源之一,以CH4和H2O为原料,通过下列反应来制备甲醇
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为。
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为。
②100℃时反应I的平衡常数为。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将移动(填“正向”、“逆向”或“不”)。
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的0.6倍,则平衡时A容器中H2的体积分数为。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为L。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式;
②写出除去甲醇的离子方程式。