2SO2(g)+O2(g) 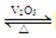 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
| A.催化剂V2O5不改变该反应的逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=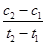 |
下列表示物质结构的化学用语或模型图正确的是
| A.HClO的结构式:H-Cl-O |
B.NH3分子的电子式: |
C.CO2的比例模型: |
D.18O的原子结构示意图: |
在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是()
A.分散质微粒的大小与分散系种类的关系: |
B.常温下溶液的pH其酸碱性的关系: |
C.硫的化合物中化合价与其氧化性、还原性的关系: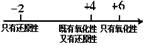 |
D.Fe在Cl2中燃烧的产物与 的关系: 的关系: |
化学与生活、社会密切相关。下列说法不正确的是()
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,主要是为了防止白色污染和节约资源 |
下列叙述中正确的是()
| A.含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH) 3的质量相等 |
| B.含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等 |
| C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应.在同温同压下,生成的CO2体积相同 |
| D.将盛有24mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4 mL无色气体,则原混合气体中O2的体积是8 mL 或 1.2mL |
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是()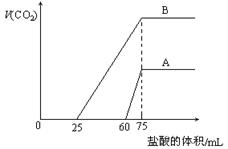
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL