反应2Z(g) X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
| A.加入催化剂,X的产率增大 |
| B.升高温度,Y的转化率增大 |
| C.当容器活塞可活动时,充入稀有气体,平衡不移动 |
| D.充入Z气体时,Z的转化率增大 |
下列反应离子方程式正确的是
A.Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S Fe2++S↓+2H+ Fe2++S↓+2H+ |
B.碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++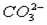 +OH- +OH- CaCO3↓+H2O CaCO3↓+H2O |
C.氯化铝溶液中加入过量氨水:Al3++3OH- Al(OH)3↓ Al(OH)3↓ |
D.澄清石灰水中通入过量CO2:OH-+CO2  |
在AlCl3和FeCl3混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
| A.Fe(OH)3、Al(OH)3 | B.Al(OH)3、I2 |
| C.Fe2S3、I2 | D.FeS、S、Al(OH)3 |
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是()
| A.一定有Fe2+,一定没有Fe3+、Mg2+ |
| B.一定有Fe3+存在,一定没有Fe2+、Mg2+ |
| C.一定有Fe3+,可能有Fe2+,一定没有Mg2+ |
| D.一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
实验室需要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是()
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.盐酸 | D.氨水 |