对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.加入一种反应物 | B.升高温度 | C.对平衡体系增加压强 | D.使用催化剂 |
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是( )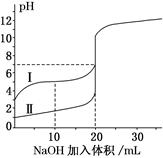
A.V(NaOH)=10.00 mL 时,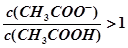 |
| B.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| C.pH=7时,两种酸所用NaOH溶液的体积相等 |
| D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-) |
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
| A.图2装置中Cu电极上发生的电极反应式为:Cu-2e-==Cu2+ |
| B.图1为原电池装置,Cu电极上产生的是O2 |
| C.由实验现象可知:金属活动性Cu>Cr |
| D.两个装置中,电流均由Cr电极流向Cu电极 |
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO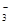 )+c(H2CO3)+2c(CO )+c(H2CO3)+2c(CO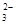 ) ) |
| B.pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)< c(H+) |
关于下列各装置图的叙述中,不正确的是( )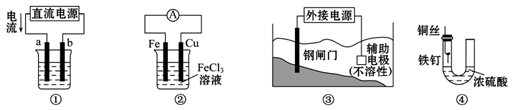
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的( )
A.向该混合溶液中加入少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
C.该混合溶液中c(SO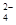 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液