已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨)+O2(g)= CO2(g) △H=-393.51 kJ• mol-1
C(金刚石)+O2(g)= CO2(g) △H=-395.41 kJ• moL-1
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B.标准状况下,22.4 L Cl2与水反应转移的电子数为NA |
| C.28 g聚乙烯含有的碳原子数为2NA |
| D.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
化学源于生活又用于生活,下列有关应用不正确的是
| A.用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果 |
| B.淀粉、油脂、蛋白质都是天然高分子化合物 |
| C.加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D.含硫化石燃料的大量燃烧是酸雨形成的主要原因之一 |
某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( )
| A |
B |
C |
|
| Ⅰ |
0.050mol·L-1 |
0.050mol·L-1 |
0.050mol·L-1 |
| Ⅱ |
0.070mol·L-1 |
0.070mol·L-1 |
0.098mol·L-1 |
| Ⅲ |
0.060mol·L-1 |
0.060mol·L-1 |
0.040mol·L-1 |
| Ⅳ |
0.080mol·L-1 |
0.080mol·L-1 |
0.12mol·L-1 |
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )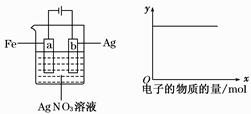
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
| A.①③ | B.③④ | C.①②⑤ | D.①②④ |
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:
2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |