随着生活水平的提高,人们越来越关注自身的健康。请回答:
(1)向淀粉溶液中加入碘水,溶液呈蓝色,再往该溶液中滴加维生素C溶液,现象是蓝色消失,该实验说明了维生素C具有 性。
(2)提纯蛋白质可以采用的一种方法是 (填“盐析”或“过滤”)。
有机物A为茉莉香型香料。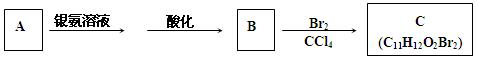
(1)A分子中含氧官能团的名称是。
(2)C的分子结构可表示为如下图(其中R代表烃基)。 A分子结构中只有一个甲基,A的结构简式是。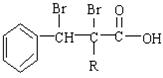
(3)B不能发生的反应是(填编号)。
| A.氧化反应 | B.加成反应 | C.取代反应 | D.水解反应 |
(4)在浓硫酸存在下,B与乙醇共热生成化合物
C13H16O2的化学方程式是。
(5)在催化剂作用下,B发生聚合反应生成聚合物的化学方程式是
。
(共10分)根据下面的反应路线及所给信息填空。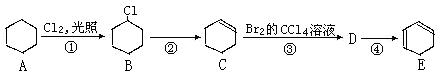
Ⅰ、②的反应条件是____;B的名称是_____;
Ⅱ、①的反应类型是 。④的反应类型是。
。④的反应类型是。
Ⅲ、写出D在NaOH溶液里发生的化学反应方程式:。
已知25℃时部分弱电解质的电离平衡常数数据如下表: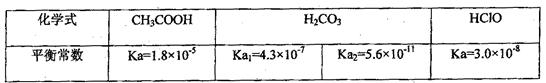
回答下列问题:
( 1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是(用字母表示)
d.NaHCO3;pH由小到大的排列顺序是(用字母表示)
(2)常温下,0.1mol·L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是
| A.c(H+) | B.c(H+)/c(CH3COOH) |
| C.c(H+)·c(OH-) | D.c(OH-)/c(H+) |
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示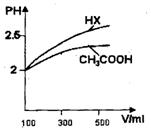
则 HX的电离平衡常数CH3COOH的
HX的电离平衡常数CH3COOH的 电离平衡常数(填大于、小于或等于)理由是
电离平衡常数(填大于、小于或等于)理由是
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)—c(Na+)=mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=
芳香族化合物A有如下图的转化关系: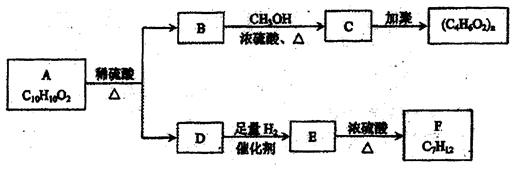
已知D能与NaOH溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请 回答下列问题:
回答下列问题:
(1)D中官能团的名称为
(2)B的分子式是
(3)A、F的结构简式:AF
(4)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:()
E→F:( )
)
(5)符合下列3个条件的A的同分异构体有多种
①苯环含有的二取代结构处于对位
②遇FeCl2溶液不变色
③能发生银镜的
请写出其中两种的结构简式
短周期元素A、B、C、D、E在元素周期表中的 位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。
位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。
请回答下列问题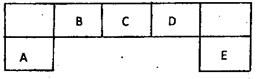

(1)描述D在元素周期表中的位置:
(2)比较A、C、D元素简单离子半径的大小:____>>(填微粒符号)
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈性,用离子方程式解释原因。
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式
(6)E的最高价氧化物的水化物的化学式为。E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为