有一包白色粉末,含有Ba(NO3)2、CaCl2、K2CO3中的2种。为确定其成分,现做以下实验。结合资料卡片中的物质溶解性,试分析:
资料卡片:一些物质的溶解性
| |
OH- |
CO |
Cl- |
NO |
| Na+ |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微 |
不 |
溶 |
溶 |
| Ba2+ |
溶 |
不 |
溶 |
溶 |
| Mg2+ |
不 |
微 |
溶 |
溶 |
(1)将少量白色粉末加入足量水中,振荡,有白色沉淀生成。
通过上述现象可初步判断原白色粉末中一定含有的物质是 (填化学式)。
(2)过滤得到(1)中所产生的白色沉淀及滤液。
实验室中进行过滤操作时,通常需要下列玻璃仪器中的 (填序号)。
a. 玻璃棒 b. 普通漏斗 c. 烧杯 d. 容量瓶
(3)再继续向滤液中加入AgNO3溶液和过量稀硝酸,最终有白色沉淀生成。
第(3)步实验及现象说明,原白色粉末中一定还含有的物质是 (填化学式),若将(2)中的白色沉淀溶于稀硝酸时,发生反应的化学方程式是
。
水的电离平衡如图所示.
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为
(2)将100℃时p H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件;所改变的条件分别:
②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;该反应的△H _____0;(填“>”、“<”、或“=”)理由是_________________________________________。
(3)该反应进行到4.0min时的平均反应速率:
实验③:v(B)=___________________。
按下图装置进行实验,已知C1、C2为石墨棒。回答下列问题
(1)判断装置的名称:A池为___________ B池为______________
(2)锌极为__________极,电极反应式为______________________ ___;
___;
铜极为__________极,电极反应式为___________________ ______;
______;
石墨棒C1为______极,电极反应式为________________________;
石墨棒C2附近发生的实验现象为_______________________________
(3)当C2极析出224mL气体(标准状况下)时,锌的质量_________(填“增加”、“不变”或“减少”)了_________g,CuSO4溶液的质量_________(填“增加”、“不变”或“减少”)_________g。
20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4 min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
| A |
B |
C |
D |
|
| SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
| SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
| O2 |
2 mol |
1 mol |
0 mol |
5 mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是(填写序号);
a.v(C)="2v(B)"
b.容器内压强保持不变
c.v逆(A)=2v正(B)
d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为(用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K=;
(4)已知:K(300℃)>K(350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A的转化率(填“增大”、“减小”或“不变”);
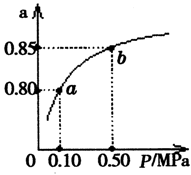
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)K(B)(填“>”、“<”或“=”)。