20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4 min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
| |
A |
B |
C |
D |
| SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
| SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
| O2 |
2 mol |
1 mol |
0 mol |
5 mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
填空题
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了(填名称)而被人体吸收。
②蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬等)是(填“酸性食物”或“碱性食物”)。
(2)2005年10月12日,中国自主研制的“神舟六号”载人飞船,在卫星发射中心发射升空,准确进入预定轨道,并成功返回。
钛作为一种重要的航天金属,在“神州六号”飞船上得到广泛的应用,航天员所用的“手杖”即是用钛制成,工业上可用钠、镁还原钛的卤化物(熔融状态)来制备,写出镁还原四氯化钛的化学反应方程式_________________________________________。
下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题:
| ① |
② |
||||||||||||||
| ③ |
④ |
⑤ |
⑥ |
(1)①元素在周期表中的位置是第二周期族。
(2)②和⑤两种元素中原子半径较大的是(填元素符号)。
③和④两种元素的最高价氧化物对应水化物中碱性较强的是(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式。
.已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化: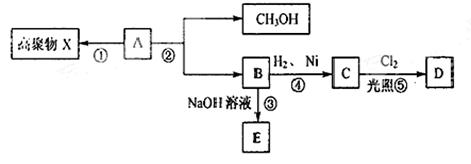
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称。
(2)②属于反应(反应类型)
(3)写出②的反应方程式。
(4)写出C的同分异构体中属于酯且能发生银镜反应的结构简式
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下: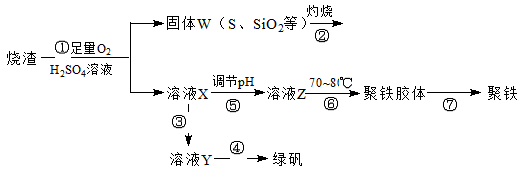
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是(化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是。
已知:常温常压下,D、E、F、I、J为气体; 1molE与含1molF的水溶液恰好反应生成B。B是一种常见的化肥。物质 之间有如下图所示转化关系(部分反应中生成的水已略去)。
之间有如下图所示转化关系(部分反应中生成的水已略去)。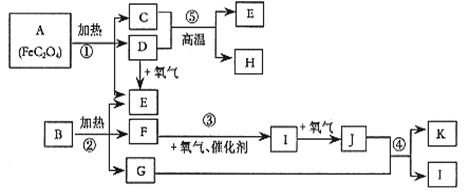
试回答下列问题:
(1)已知A中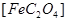 和C中Fe元素均为+2价,则
和C中Fe元素均为+2价,则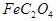 中碳元素的化合价为______
中碳元素的化合价为______
(2)B的化学式为___________________。
(3)写出反应③的化学方程式 _______________________ _____。
(4)写出过量单质H与K的稀溶液反应的离子方程式:_____________________。