填空题
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了 (填名称)而被人体吸收。
②蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬等)是 (填“酸性食物”或“碱性食物”)。
(2)2005年10月12日,中国自主研制的“神舟六号”载人飞船,在卫星发射中心发射升空,准确进入预定轨道,并成功返回。
钛作为一种重要的航天金属,在“神州六号”飞船上得到广泛的应用,航天员所用的“手杖”即是用钛制成,工业上可用钠、镁还原钛的卤化物(熔融状态)来制备,写出镁还原四氯化钛的化学反应方程式_________________________________________。
莫沙朵林是一种镇痛药,它的合成路线如下: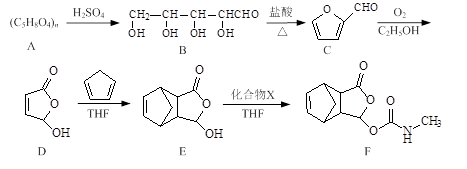
⑴B中手性碳原子数为 ;化合物D中含氧官能团的名称为 。
⑵C与新制氢氧化铜反应的化学方程式为 。
⑶写出同时满足下列条件的E的一种同分异构体的结构简式: 。
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
⑷已知E+X→F为加成反应,化合物X的结构简式为 。
⑸已知: 。化合物
。化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:


图Ⅰ图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下: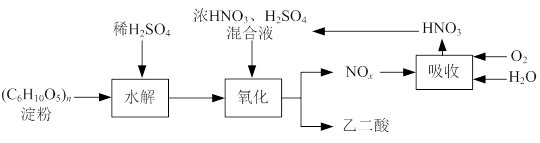
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
⑴检验氧化后的溶液中是否仍含有葡萄糖的实验方案为。
⑵氧化时控制反应液温度为55~60℃的原因是。
⑶若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为。
⑷生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行。已知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。
回答:
(1)A为________元素,B为________元素,C为________元素,D为________元素。
(2)C元素在周期表中属________周期________族元素,其原子电子排布式为________。
(3)B与C形成的非极性分子的电子式是________。其中共价键类型及数目是________。(填σ键或π键)
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。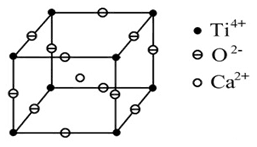
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 ,该物质的化学式可为 。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),阿伏加德罗常数为6.02×1023 mol-1,则该晶体的密度为 g·cm-3。