甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序 ;
(3)丙与庚的原子核外电子数相差 ;
(4)戊单质电子式为 ,写出一种含戊、己两种元素的离子化合物的化学式 。
如下表所示,上、下两横行分别是含碳、含氮的物质。纵行,如CH4、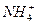 互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。
互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。
| CH4 |
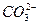 |
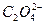 |
||
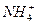 |
 |
N2 |
有A、B、C、D四种不同元素的原子,A、C、D具有相同的电子层数,A的M层比C的M层多4个电子,比D的M层少2个电子,B的L层比A的L层少3个电子。画出A、B、C、D的原子结构示意图。
核电荷数小于18的两种元素A、B,A原子最外层电子数为a,次外层电子数为b;B原子M层电子数为(a-b),L层电子数为(a+b)。则A是___________元素,B是___________元素。
现有两种氧原子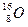 和
和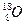 ,它们可分别形成16On和18Om两种气体单质。请完成下列问题:
,它们可分别形成16On和18Om两种气体单质。请完成下列问题:
(1)1 mol 16O中所含的中子数为__________个,1 mol 18O中所含的中子数为__________个。
(2)1 mol 16On中所含的中子数为____________mol,1 mol 18Om中所含的中子数为____________mol。
(3)若在同温、同压、同体积时,16On和18Om的中子数之比为6∶5,则n∶m=____________。
有若干克某金属,其各原子核内共有3.5×6.02×1023个中子,同质量的该金属和稀硫酸反应共有0.2 mol电子发生转移,生成6.02×1022个阳离子,这些阳离子共有3.0×6.02×1023个质子,则该金属摩尔质量为______________,原子核内有______________个质子,______________个中子,其核组成符号为______________。