化学史上很多重要物质的发现背后都有科学家们的兴趣、坚持、创新与传承。例如氨的发现史,阅读下文并填空。
1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为 ,水吸入曲颈瓶的原理与 实验相同。氨的电子式为 ;
1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨)。他还研究了氨的性质,他发现 ;
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为 ,预期该反应在生产上 (填有或无)实际用途。
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是 ,据此证实了氨是氮和氢的化合物。其后戴维等化学家继续研究,进一步证实了氨的组成。
滴定管精确到 ml,滴定管分为 和 两种,酸性高锰酸钾溶液应装在 滴定管中,滴定管在使用前除需水洗和润洗外还需 。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强P1比P2 (填大或小);
(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);
(4)正反应为 反应。
(1)FeCl3溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_____________(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)将氯化铝溶液蒸干灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
如下图所示: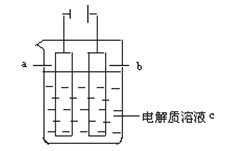
(1)a电极是_________(填“阴极”或“阳极”),b电极是_________(填“阴极”或“阳极”)。
(2)当电解NaCl溶液时:
①a电极的电极反应为________________,该反应是_______(填“氧化”或“还原”)反应;
②b电极的电极反应为______________,该反应是_________(填“氧化”或“还原”)反应。
(3)当电解精炼铜时:
①a电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________;
②b电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________。