在容积为10L的密闭容器中,通入40molN2和120molH2,在一定条件下进行反应,2s后达到平衡状态,此时N2的浓度是2mol/L,试求:
(1)用H2的浓度变化表示的2s内的平均反应速率为多少?
(2)N2的转化率为多少?
(3)平衡时NH3的体积分数为多少?(要求有计算过程)
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl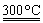 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请完成下列问题:
(1)第①步制备粗硅的化学反应方程式为________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为:________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):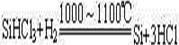
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是:________________。
②反应一段时间后,装置D中观察到的现象是________________________,装置D不能采用普通玻璃管的原因是________________,装置D中发生反应的化学方程式为________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
下列两个反应的反应原理是否存在矛盾?为什么?
①Na2SiO3+CO2+H2OH2SiO3↓+Na2CO3
②SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅单质为什么在常温下性质稳定?
有一无色气体中可能含有CO2、CO、H2O(g)、H2中的一种或几种,将该气体依次进行如下处理(假定每次处理均反应完全):
(1)通过碱石灰时,气体体积变小。
(2)通过赤热的氧化铜时,固体变为红色。
(3)通过白色硫酸铜粉末时,粉末变为蓝色。
(4)通过澄清石灰水时,溶液变浑浊。
由此可以确定原无色气体中:一定含有_______,可能含有________。
根据烷、烯、炔烃燃烧的反应式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0体积混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2体积(相同状况下测定),通过计算确定C2H6和C3H4的体积。(设体积单位为升)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气(相同状况下测定)。
①判断混合气体有________________两类烃组成。
②上述判断的理由是_____________________________________________
(用简要文字叙述)。
③上述两类烃的体积比为_________。