化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)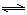 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g) 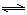 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 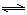 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)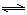 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 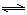 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 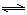 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :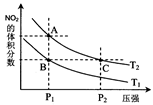
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
(选修)根据所学知识完成下列填空。
(1)鉴别真假羊毛衫的方法是先取样,再;在净水过程中氯气的作用是,a_氨基乙酸的结构简式为。
(2)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。其中属于解热镇痛的药物是,青霉素的作用是,碳酸镁可治疗胃酸过多的原理是(用离子方程式表示)。
(3)药片常用淀粉作黏合剂,淀粉水解的最终产物是。
(选修)下面是小王在医院做的血常规检查报告单的部分内容,小王应该注意补充的微量元素是()
| No |
项目 |
结果 |
正常范围参考值 |
单位 |
| 1 |
红细胞计数 |
2.3 |
3.5~5 |
1×1012/L |
| 2 |
血红蛋白 |
75 |
110~150 |
g/L |
| 3 |
血小板计数 |
205.5 |
100~300 |
109/L |
A.硒 B.锌 C.铁 D.碘
(1)下表列出了a-f六种元素在周期表前三周期的位置。
| a |
|||||||
| b |
c |
||||||
| d |
e |
f |
请回答下列问题:
①c元素的名称是,d元素位于族。
②用元素符号表示,六种元素中,元素的性质最稳定,元素的原子半径最大。
③非金属性bc。(填“大于”“小于”)
④用化学式表示,六种元素中,最高价氧化物属于两性氧化物的是,最高价氧化物对应水化物酸性最强的是。
(2)
①有机气体A是一种植物生长调节剂,其相对分子质量为28。A通入溴水中,能使溴水褪色。A的分子式是,其与溴水反应的化学方程式是,反应类型为反应。
②同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。C4H10有两种同分异构体,其结构简式分别是,。
(14分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下图所示的转化关系:
试回答下列问题:
(1)A是,C是
(2)B的溶液与NaOH溶液混合的现象是,相应的化学方程式为、。
(3)反应①的反应类型是反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。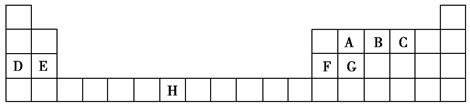
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。