Ⅰ.在一定条件下,xA+yB 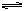 zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。
Ⅱ.已知NO2和N2O4可以相互转化:
2NO2(g) 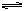 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。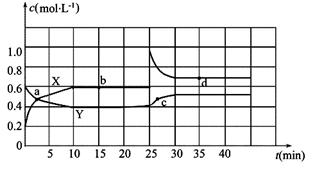
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g) 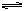 N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g) 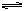 N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是___________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性(填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱。
(4)请写出下列物质的电子式。H2OCO2。
有下列各组物质:
A O2和O3(臭氧)B 和
和
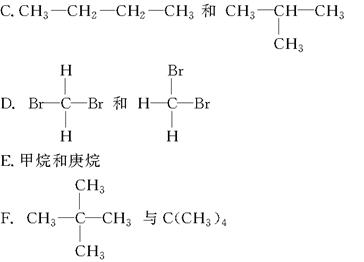
G.CH3COOH与HCOOCH3H.金刚石与石墨
(1)组两种核素互为同位素;(2)组两物质互为同素异形体;
(3)组两物质属于同系物;(4)组两物质互为同分异构体;
苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。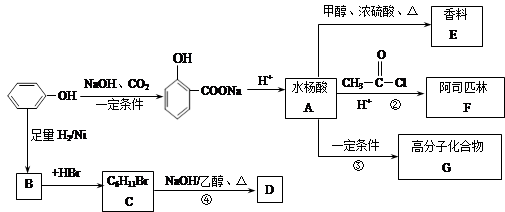
已知(1)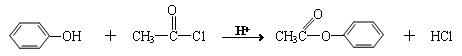
(2)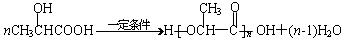
(3)R—OH+HBr R—Br+H2O
R—Br+H2O
(1)写出反应类型:反应④属于_____________反应,反应③属于________________反应。
(2)写出下列有机物的结构简式:E___________、G_____________、F____________。
(3)可以检验阿司匹林样品中含有水杨酸的试剂是__________(填写字母)。
| A.碳酸氢钠溶液 | B.氯化铁溶液 | C.红色石蕊试液 | D.新制氢氧化铜悬浊液 |
(4)与阿司匹林互为同分异构体的物质有多种,请按以下要求写出阿司匹林的一种同分异构体:①苯环上有两个对位的取代基;②能发生银镜反应;③含有酯基和羧基的有机物________________________。
(共10分)有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:
(1)D的分子式为;
(2)E中所含官能团的名称为;
(3)Ⅲ的反应类型为(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为;
(5)E有多种同分异构体,其中一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为。
某有机物X的分子式为C4H8O2
(1)若X能与NaOH溶液反应,则符合题意的X的结构式有种
(2)若X在酸性条件下与水反应,生成两种有机物Y和Z,Y在铜催化剂下被氧化为W,W能发生银镜反应
①W中所含官能团名称是
②符合题意的X结构有种
③若Y与Z含有相同的碳原子数,写出W与新制氢氧化铜反应的化学方程式。