氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程: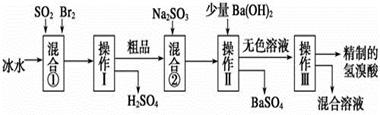
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是___________ ______________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。 于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。

(甲)(乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
| 乙酸 |
1-丁醇 |
乙酸丁酯 |
|
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶 (9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①;②
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。




A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有。
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
| 完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是;
H2O2参加反应的离子方程式为。
(2)加稀氨水调节pH的目的是,pH应调至范围。下列物质可用来替代稀氨水的是。
①NaOH②Fe2O3③CuO④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括、、
过滤、、干燥等步骤。
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)  NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式。
(3)按下图装置进行如下实验:
步骤1:检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入足量的氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有。
③以恒压滴液漏斗代替分液漏斗的目的是。
④反应后期随着CO2气流减慢,导致反应物比例不当,可采取的相应措施是。
(4)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是。
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]·nH2O可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验Ⅰ.草酸根含量的测定
称取0.9820 g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358 K,用0.2000
mol/LKMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4溶液12.00 ml。
实验Ⅱ.铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00 ml。(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题
(1)实验Ⅰ在滴定过程中反应的离子方程式为。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。若实验Ⅱ中没有对实验Ⅰ的保留液进
行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为。
(4)通过计算确定样品晶体的组成(写出计算过程)。
MnO2是一种重要的催化剂。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)写出1个用二氧化锰作催化剂的化学反应方程式。
(2)第②步反应的离子反应方程式为。
(3)检验过滤Ⅰ所得的MnO2是否洗涤干净的方法是。
(4)第③步反应的化学反应方程式为。
(5)上述流程中可用于循环使用的物质是(填化学式);过滤操作和蒸发操作中都要用到的玻璃仪器是。
(6)若粗MnO2样品的质量为25.38g,第①步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则样品中所含的MnO质量为g。