二氧化铈CeO2是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: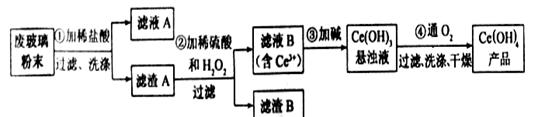
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验滤渣A是否洗涤干净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、量筒等。
(4)取上述流程中得到的Ce(OH)4[M=208g/mol]产品0.500g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定(铈被还原为Ce3+),消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为 。(保留两位小数)
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① |
4 |
10 |
30 |
|
| ② |
5 |
60 |
10 |
|
| ③ |
60 |
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,
请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:;假设三:;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为主要原料制备环己烯。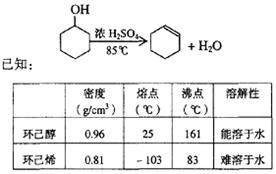
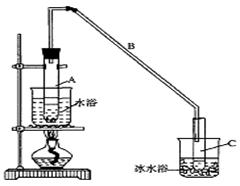
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入(填“g”或“f”)。收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是; 简述混合液体时最后加入浓硫酸的理由:。
简述混合液体时最后加入浓硫酸的理由:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。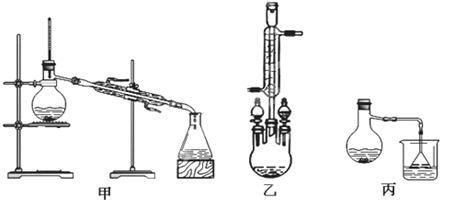
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ操作Ⅱ。 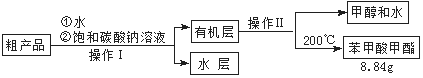
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),
并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。
(8分)【化学一化学与技术】
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。
(12分)A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。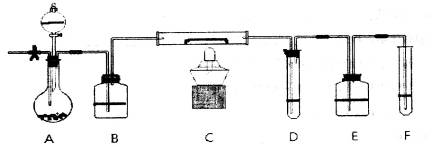
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。