某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是 ; 简述混合液体时最后加入浓硫酸的理由: 。
简述混合液体时最后加入浓硫酸的理由: 。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用 装置(填“甲”或“乙”或“丙”)。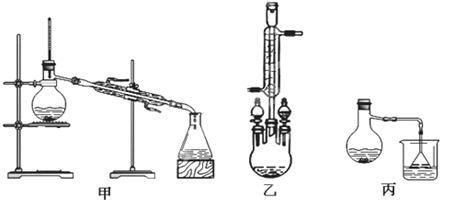
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ 。 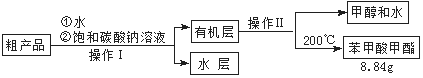
(4)能否用NaOH溶液代替饱和碳酸钠溶液? (填“能”或“否”),
并简述原因 。
(5)通过计算,苯甲酸甲酯的产率是 。
甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。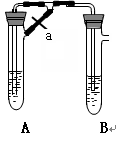
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:
①通过试管乙中发生的 现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有 性。
②写出试管甲中所发生反应的化学方程式 。
③该反应体现了浓硫酸的性和性。
除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为。
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、分液等。下列各组混合物的分离或提纯应采用什么方法?
①提取碘水中的碘,可用法;
②从氢氧化铜的悬浊液中分离出氢氧化铜,可用法;
③除去食盐水中的水,可用法;
④分离植物油和水,可用法。
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质是______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B , D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:
。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?