某同学设计了测定空气中氧气含量的实验,实验装置如图所示.该同学的实验步骤如下:
①将图中的集气瓶分为5等分,并做好标记;
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞;
③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是:______,点燃红磷时能看到的现象是______,写出红磷燃烧的文字表达式
(2)步骤③中打开止水夹后观察到的现象是: 。
(3)本实验体现了氮气具有的性质是 (任写一点)。
(4)通过本实验测得氧气小于空气体积的l/5,则可能的原因有哪些?(答出一点即可).
实验室制取氯化氢气体采用:硫酸(浓)+氯化钠 氯化氢+硫酸钠,其反应的化学方程式为 ,干燥的氯化氢不能使干燥的蓝色石蕊试纸变红,说明干燥的氯化氢气体中 (填“有”或“没有”)H+。
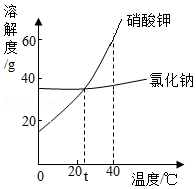
如图是NaCl和KNO3在不同温度下的溶解度曲线,根据曲线回答下列问题。
(1)t℃时,饱和NaCl溶液与饱和KNO3溶液的溶质质量分数 (填“相同”、“不同”或“无法确定”)。
(2)40℃时,相同质量的饱和NaCl溶液与饱和KNO3溶液均降温至20℃,析出晶体质量较多的是 。
氯原子结构示意图及在元素周期表的信息如图,据图可知,氯元素的相对原子质量为 。氯原子易得到电子形成离子,其符号是 。

化学就在我们身边,人类的生活离不开化学,回答下列问题。
(1)人们穿的衣服通常是由纤维织成的,下列属于天然纤维的是 。
A.蚕丝 B.涤纶 C.棉花 D.尼龙
(2)水是一种重要的自然资源,是生产、生活必不可少的物质。
①生活中可以通过 的方法,既可以杀灭水中的细菌,又可以降低水的硬度。
②下列各种水中属于纯净物的有 。
A.矿泉水 B.糖水 C.蒸馏水 D.自来水
(3)服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症,反应的化学方程式为 ,该反应属于 (填基本反应类型)。
(4)吸烟除了影响自身的健康外,也会使周围的人“被动吸烟”,其原因是 (从微观角度解释)。
(1)如图是一种处理汽车尾气的反应微观示意图,回答下列问题。

①从微观上看,该化学变化中发生改变的粒子是 (填“分子”或“原子”),反应前后原子的数目 (填“有”或“没有”)增减。
②参加反应的 和
和 的分子个数比为 ,该反应中涉及到的单质的化学式为 。
的分子个数比为 ,该反应中涉及到的单质的化学式为 。
(2)如图是A、B、C、D四种粒子的结构示意图

①图中共有 种元素。
②C粒子的符号为 ,由 B、C两种粒子构成的化合物的化学式为 。