已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是
| A.将NaCl溶液蒸干可得NaCl固体 |
| B.将MgCl2溶液蒸干可得MgCl2固体 |
| C.可用MgCl2和NaClO3制备Mg(ClO3)2 |
| D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
下列解释事实的化学方程式或离子方程式不正确的是( )
| A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O=2Fe(OH)2 |
| B.SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- |
| C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH=2A1O2-+H2O |
D.84消毒液和洁厠灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2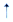 +H2O +H2O |
化学概念在逻辑上存在如下关系: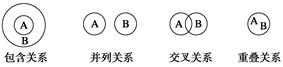
对下列概念的说法正确的是( )
| A.化合物与电解质属于重叠关系 |
| B.化合物与碱性氧化物属于交叉关系 |
| C.溶液与胶体属于并列关系 |
| D.离子化合物和电解质属于交叉关系 |
下列变化属于物理变化的是()
| A.电解质溶液的导电 | B.石油裂解 |
| C.煤的干馏 | D.四氯化碳萃取碘水中的I2 |
在pH=13的无色溶液中,下列各组离子能大量共存的是
| A.K+、Na+、HCO3- 、NO3- | B.Na+、NH4+、NO3-、Cl- |
| C.K+、Na+、NO3-、Br - | D.K+、Cu2+、Cl-、SO42- |
下列叙述不正确的是
A.用电子式表示HCl的形成过程: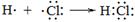 |
B. 中的原子核内的中子数与核外电子数之差是99 中的原子核内的中子数与核外电子数之差是99 |
C.在空气中加热金属锂:4Li+O2 2Li2O 2Li2O |
D.铝热法炼铁:2Al+Fe2O3 2Fe+ Al2O3 2Fe+ Al2O3 |