用于分离或提纯物质的方法有:
| A.蒸馏(分馏) | B.萃取 | C.过滤 | D.重结晶 E.分液。 |
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙 (2)分离四氯化碳与水的混合物
(3)分离汽油和煤油 (4)分离碘水中的碘单质
(5)KNO3晶体中含有少量食盐 。
某温度下,纯水电离出的c(H+)=2×10—7mol/L。
(1)该温度下,0.1mol/L 盐酸的PH=,0.1mol/L NaOH溶液中的c(H+)=
(2)该温度下,pH=13的NaOH溶液中的c(OH—)是pH=11的NaOH溶液中的c (OH—)的倍,若将两者以等体积混合,所得溶液pH值为。(lg2=0.3,lg3=0.5,lg5=0.7)
(3)该温度下,等物质的量浓度的NaOH溶液与盐酸按3∶2体积比混合(不考虑混合时的体积变化),所得溶液的pH值为12,它们的浓度为。
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2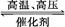 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS="-198.2" J·K-1·mol-1。请判断上述氨气的合成在温度298K时(能、否)自发发进行。
已知可逆反应:M(g)+N(g) P(g)+Q(g)ΔH>0,请回答下列问题:
P(g)+Q(g)ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)="1" mol·L-1,c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为;
(2)若反应温度升高,M的转化率(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)="4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=;
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=b" mol·L-1,达到平衡后,M的转化率为。
(16 分)目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______。
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是。PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为,阴极上观察到的现象是;
若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
(18 分)A、B、C、D、E、F 是周期表中的前20 号元素,原子序数逐渐增大。A 元素是宇宙中含量最丰富的元素,原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C 元素原子最外层p 能级比s 能级多1 个电子;D 原子p 轨道上成对电子数等于未成对电子数;E 的常见化合价为+3;F 最高正价与最低负价的代数和为4; G+的M 层电子全充满。用化学式或化学符号回答下列问题:
(1)G 的基态原子的外围电子排布式为,周期表中F 属于 区。
(2)B 与F 形成的一种非极性分子的电子式为 ;F 的一种 具有较强还原性的氧化物分子的VSEPR 模型为
(3)BD2在高温高压下所形成的晶胞如图所示。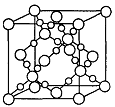
该晶体的类型属于_______(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C 元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3 种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为 。
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4 混合后,溶液中各离子浓度大小顺序为 。
(6)A 和C 形成的某种氯化物CA2Cl 可作杀菌剂,其原理为CA2Cl 遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl 与水反应的化学方程式:___________________________
(7)往G 的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X 的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体