元素周期律是指元素的性质随 的递增,而呈 性变化的规律,这里元素的性质主要是指 和 ;提出元素周期律并根据周期律编制第一个元素周期表的科学家是 。
【化学—选修3:物质结构和性质】
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式、,其中酸性较强的是。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。
【化学—选修2:化学与技术】
生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。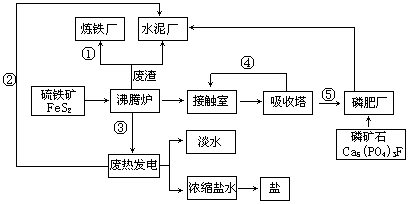
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在( )
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 ,(请写出两点)。
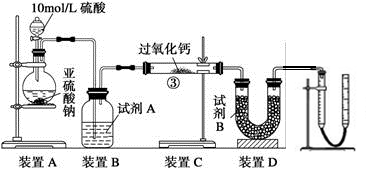 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、、Na2SO4、NaHSO4 |
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。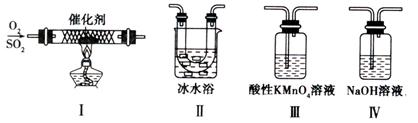
①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3—4min之间,化学平衡向_______反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。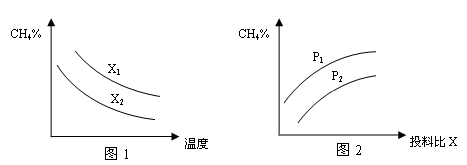
①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为____。
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
①试剂Y的名称;物质X最好是(填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·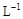 ,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)
,则加入Cl2气和物质X使溶液的pH在范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20、lg5=0.7)