海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴海水中含有大量的氯化钠。请写出氯离子结构示意图 。
⑵目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)。
⑶工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为 。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫 的方法,该方法的流程如下:
的方法,该方法的流程如下:
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④____________ _________________________。
_________________________。
已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E(分子式为C4H8O2),其合成路线如下图所示。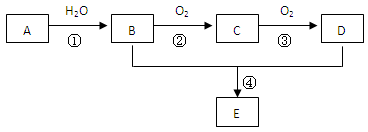
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的化学方程式:
①;反应类型:。
④;反应类型:。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有和。
(2)锌与盐酸反应速率可以通过观察进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是或。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因。
(9分)(1)按下图装置进行实验,可观察到的现象有:。其中Zn极发生反应(填“氧化”或“还原”),写出电极反应式。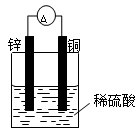
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2溶液,气泡放出的速率加快。其原因是。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。下图是氢能源循环体系图。回答下列问题:
(1)图中两个框中的X、Y为循环过程中反应物和生成物的分子式。则X是;Y是、(填分子式)。
(2)从能量转换的角度看,过程II主要是_______能转化为________能。
(3)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式
(本小题满分8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
0 |
50 |
120 |
232 |
290 |
310 |
(1)哪一段时段的反应速率最快,原因是。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)。