Ⅰ.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)  C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
C8H8(g)+H2(g)ΔH=120 kJ·mol-1。某温度下,将0.40 mol苯乙烷,充入2 L真空密闭容器中发生反应,
测定不同时间该容器内气体物质的量,得到数据如下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(C8H10)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(C8H8)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
(1)当反应进行到20 min时,该段时间内H2的平均反应速率是_____ ___。
(2)该温度下,该反应的化学平衡常数是________ ________。
(3)若保持其他条件不变,用0.50 mol H2(g)和0.50 mol C8H8(g)合成C8H10(g),当有30 kJ热量放出时,该反应中H2的转化率是________________。此时,该合成反应是否达到了平衡状态?________(填“是”或“否”),且正反应速率 逆反应速率(填大于、小于或等于)
(4)对于反应C8H10(g)  C8H8(g)+H2(g),下列说法正确的是
C8H8(g)+H2(g),下列说法正确的是
A、恒温恒容条件下C8H10(g)和C8H8(g)生成速率相等能说明该反应达到平衡状态
B、压强增大该反应的平衡常数也增大
C、在恒温恒压条件下,有2 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH1,另有4 mol C8H10(g)在容器中完全反应,该反应的反应热为ΔH2,则ΔH2=2ΔH1
Ⅱ.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图: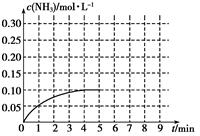
(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1 ④0.08 mol·L-1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
目前“低碳经济”正成为科学家研究的主要课题。请回答 下列问题
I.甲烷自热重整是一种先进的制氢方法其反应方程式为:CH4(g) + H2O(g) ="CO(g)" + 3H2(g)
(1)阅读下图计算该反应的反应热ΔH = __________kJ/mol。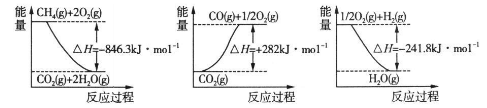
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池则负极的电极反应式为___________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为_____,各离子浓度由大到小的顺序为_______________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) =5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。
请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________填字母序号)。
| A.容器内气体密度不变表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________
(3)下列有关镓和镓的化合物的说法正确的是____________________(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题: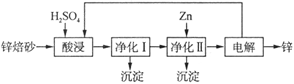
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式_______________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________。
(6)净化II中加入Zn的目的是______________________________________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________________。已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
[化学——选修5有机化学基础]某酯M常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。已知M的分子式为C10H10O2且分子中只含有1个苯环,苯环上只有一个取代基。实验测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3。已知M分子的红外光谱如下图:
试回答下列问题。
(1)M的结构简式为。
(2)G为M的一种同分异构体,其分子结构模型如图所示:
(图中球与球之间连线表示单键或双键)。用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有(填名称)。
②A→B的反应类型是,E→F的反应类型是。
③书写化学方程式
C→DE→F
④E的同分异构体甚多,符合下列条件的同分异构体共有种,试写出符合条件的所有同分异构体的结构简式;。
i.含有笨环表苯环上有三个取代基;
ii.苯环上的一元取代产物只有两种;
iii.能发生银镜反应但遇FeC13溶液不显色。
[化学——选修3物质结构与性质l(15分)三聚氰胺(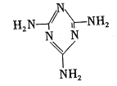 )俗称。蛋白精”,可以由下列反应合成:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
)俗称。蛋白精”,可以由下列反应合成:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:;CaCN2中阴离子为CN22一,与CN22一互为等电子体的分子有N2O和(填化学式),由此可以推知CN22一的空间构型为____。
(2)三聚氰胺中氮原子的杂化方式有。
(3)一些不法商家常在牛奶中加入三聚氰胺和三聚氰酸来提高“蛋白质”的含量,人在摄人三聚氰胺和三聚氰酸(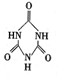 )后,两者之间易通过结合,在肾脏内易形成结石。
)后,两者之间易通过结合,在肾脏内易形成结石。
(4)钙的氧化物有CaO和CaO2两种,其晶胞结构如下图所示,CaO晶体中Ca2+的配位数为,Ca2+采取的堆积方式为。已知CaO2密度是ρg·cm-3,晶胞结构如图所示,则CaO2晶胞中距离最近的两个钙离子间的距离为cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。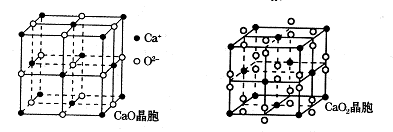
(5)配位化合物K3[ Fe( CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=。
[化学——选修2:化学与技术](15分)某地煤矸石经预处理后含SiO2( 63%)、Al2O3( 25%) 、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):。
(2)物质X足量时,“转化”过程中发生反应的有关离子方程式为。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.7,A13+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al( OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是,然后再加入CaCO3,调节pHCaCO3若只pH到5.4,过滤得到Al( OH)3。
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向A1Cl3饱和溶液中不断通入HC1气体,可析出大量A1Cl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:。
(5)工业上电解冶炼铝的原料用Al2O3而不用A1Cl3其原因是。电解Al2O3冶炼铝时,阳极材料是,阳极需要定期更换,其原因是。