蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁实验步骤如下: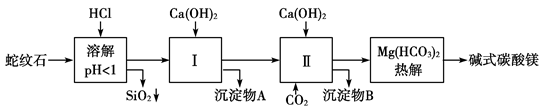
已知:
| 氢氧化物 |
Fe(OH) 3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有 。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是 。
(4)高温煅烧碱式碳酸镁aMgCO3·bMg(OH)2·cH2O得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式为 。(写出计算过程,否则不得分)
将铁投入到稀硝酸溶液中,会发生如下反应:
Fe + 4HNO3(稀) = Fe (NO3)3 + NO↑ + 2H2O
(1)用双线桥法标出电子转移的方向和数目
(2)已知反应过程中消耗了28g铁,则转移电子的物质的量为 ,被还原的硝酸的物质的量为 。
(3)请将以上反应改写为离子方程式 。
下列各组物质中, 属于强电解质的是 ,属于弱电解质的是
属于非电解质的是 (填字母序号)
A HCl B硫酸钡 C NH3 D氢氧化钠 E淀粉溶液 F酒精G碳酸氢钠 H CH3COOH I FeJ HClOK H2O L SO3
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁
已知:
则CO 还原Fe2O3(s)的热化学方程式为 。
(2)尾气中的CO 主要来自于汽油不完全燃烧。有人设想按下列反应除去CO: ,简述该设想能否实现的依据: 。
,简述该设想能否实现的依据: 。
(3)CO2 和H2充入一定体积的密闭容器中,在两种温度下发生反应:
测得CH3OH 的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,此反应在恒.压.容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2 个C=O 断裂的同时有6 个H-H 断裂
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2。在0~15 小时内,CH4的平均生成速率I、II 和III 从小到大的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图3:
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4难溶于水,可溶于浓硝酸并放出红棕色气体,写出反应的离子方程 。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为: ;
;
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①对于气相反应,用某组分(B)的平衡压强( PB)代替物质的量浓度( cB)也可表示平衡常数(记作KP),写出该反应的平衡常数表达式KP= 。
②下列措施可以加快反应速率且能提高CO 转化率的是 。
a.再充入CO b.将甲醇液化并及时分离出c.增大压强
d.加入催化剂 e.降低温度
③在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH 充入容积为1L 的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料, KOH 溶液作为电解质构成燃料电池总反应为: ,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl 溶液的体积为1L,溶液的pH 为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
(1)今年来我国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是 (填字母)。
a.SO2b.NO2c.CO2d.PM2.5
(2)天然水中杂质较多,常需加入明矾,ClO2 等物质处理后才能饮用。明矾能净水的原理是 ,写出检验明矾中Al3+的实验方法 。
(3)A、B、C 三个城市全年雨水的月平均pH 变化如下图1 所示。
①受酸雨危害最严重的是 城市。
②汽车尾气中含有NO2、NO、CO 等有害气体,写出由NO2形成硝酸型酸雨的化学方程式 。
③用纳米二氧化钛光触媒技术,将汽车尾气中的NOx 和CO 转化为无害气体,写出该反应的化学方程式 。
④测量汽车尾气的浓度常用电化学气敏传感器,其中CO 传感器可用下图2 简单表示,则阳极发生的电极反应 。