针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。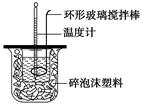
某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
H2SO4溶液的温度
(2)利用氢气可以制取工业原料乙酸。已知:
a.CH3COOH(l)+2O2(g) ==2CO2(g)+2H2O(l) △H = —870.3kJ/mo1
b.C(s)+O2(g) ==CO2(g) △H = —393.5kJ/mo1
c.H2(g) +1/2 O2(g)==H2O(l) △H = —285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是 。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2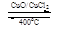 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.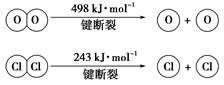
①写出此条件下,反应A的热化学方程式_________________________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测得平衡时c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1。若A2、B2、C的起始浓度分别用a mol·L-1、b mol·L-1、c mol·L-1表示,请回答:
2C达到了化学平衡状态,经测得平衡时c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1。若A2、B2、C的起始浓度分别用a mol·L-1、b mol·L-1、c mol·L-1表示,请回答:
(1)a、b应满足的关系是_______________。
(2)a的取值范围是___________。
一定温度下,C(s)和水蒸气在密闭容器中发生反应,建立平衡状态:C(s)+H2O(g) CO(g)+H2(g);ΔH>0。
CO(g)+H2(g);ΔH>0。
(1)平衡时混合气体的平均相对分子质量Mr(平)的取值范围为_______>Mr(平)>_______。
(2)若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气体的平均相对分子质量M′r(平)的取值范围为_______>M′r(平)>_______。
在一定条件下反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态的标志是:_________。
2SO3(g)达到平衡状态的标志是:_________。
①含量不变②转化率不变③浓度不变④恒容压强不变⑤恒压体积不变⑥v(正)=v(逆)⑦条件一定平均相对分子质量不变⑧体积一定,密度不变
上述条件符合H2(g)+I2(g) 2HI(g)反应的有____________________________________。
2HI(g)反应的有____________________________________。
上述条件符合A(g)+B(l) C(g)反应的有__________________________________。
C(g)反应的有__________________________________。
在一定温度下,把2 mol SO2和1 mol O2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
2SO3,当反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=______________。
(2)若a=0.5,则b=_______________和c=______________。
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):_________________、__________________。
在V L密闭容器中加入5 mol N2和10 mol H2,在一定条件下经一小时达到平衡状态,生成NH3 4 mol,则平衡时的压强与反应开始时的压强之比为_______,氢气的转化率为________,混合气体的平均式量为___________。