在一定条件下反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态的标志是:_________。
2SO3(g)达到平衡状态的标志是:_________。
①含量不变②转化率不变③浓度不变④恒容压强不变⑤恒压体积不变⑥v(正)=v(逆)⑦条件一定平均相对分子质量不变⑧体积一定,密度不变
上述条件符合H2(g)+I2(g) 2HI(g)反应的有____________________________________。
2HI(g)反应的有____________________________________。
上述条件符合A(g)+B(l) C(g)反应的有__________________________________。
C(g)反应的有__________________________________。
(1) 组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体
积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,请写出化学反应方程式: (有机物用结构简式表示)。
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为 (填任一种)。
(2) 有机物A由于其特殊的结构,一直受到理论化学家的注意,由于缺乏有效的合成途径,一度
延缓对它的研究,直到1993年出现了可以大量制备的方法,才得以被重视。A是非极性分子,
化学式是C6H8,分子的核磁共振氢谱图显示只有一个吸收峰。
①A的结构简式为 ;A分子中在同一平面上的碳原子数为 。
②A的二氯取代产物的异构体有 种。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH
如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1) 从①组情况分析, HA是强酸还是弱酸 。
(2) ②组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3) 从③组实验结果分析,说明HX的电离程度______NaX的水解程度(选填“大于”、“小于”或 “等于”),
该混合溶液中离子浓度由大到小的顺序
是 。
(4) ①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算:)。
c(Na+)-c(A-)= mol·L-1;c(OH-)-c(HA)= mol·L-1
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
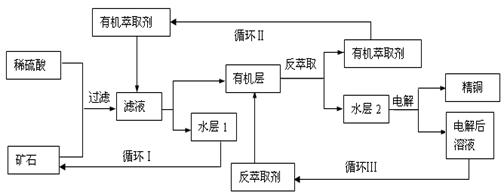 |
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
、(任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式。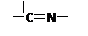 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个三种基团,无环状结构,三种基团的数
目关系为n3=。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式:。
(5)“循环Ⅲ”中反萃取剂的主要成分是。
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物。反应②、④是工业上的重要反应,部分物质及反应条件没有列出。
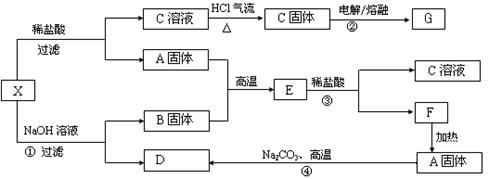 |
请回答:
(1) 写出A、B和E的化学式:A ,B ,E 。
(2) 写出C溶液转化为C固体的过程中,HCl气流的作用 。
(3) 写出①、③和④反应的化学反应方程式(若是离子反应的写离子方程式):
①
③
④
卤代烃(RX)可以合成格氏试剂(RMgX),合成格氏试剂及格氏试剂有关应用如下:(R为烃基,R1、R2为烃基或氢原子)
请回答下列问题:
⑴如上反应②的类型是。
⑵CH3CH2MgCl与CO2在酸性水溶液中反应可生成有机物X,则X的结构简式为:。
⑶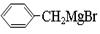 与丙酮(CH3COCH3)在酸性水溶液中反应可生成有机物Y,有机物Y的同分异构体很多,其中属于酚类且苯环上除酚羟基外只有一个取代基的同分异构体共有种。
与丙酮(CH3COCH3)在酸性水溶液中反应可生成有机物Y,有机物Y的同分异构体很多,其中属于酚类且苯环上除酚羟基外只有一个取代基的同分异构体共有种。
⑷由正丙醇合成正丁醇的合成路线如下:
请回答下列问题:
①D的化学式。
②写出与正丁醇互为同分异构体且在一定条件下能被CuO氧化,氧化产物能发生银镜反应的物质的结构简式:。 ③写出B C的化学方程式:
③写出B C的化学方程式: