(15分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应
CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
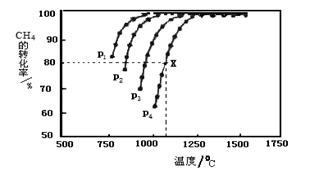
①据图可知,p1、p2、 p3、p4由大到小的顺序 。
②在压强为p4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是 。
| A.体系压强不再变化 | B.H2与CO的物质的量之比为1:1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |
②在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在右下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
(8分)已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化。
(1)图像中,曲线Ⅰ表示的酸是____(填化学式);起始时,c(CH3COOH)_____c(HClO)(填“>”、“<”、“=”)。
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)向NaClO溶液中通入少量CO2的离子方程式为____________________。
(9分)将反应IO3-+5I-+6H+ 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____________,工作过程中关于电流计的读数,下列说法正确的是_______(填编号)
a.电流计读数逐渐减小b.电流计读数有可能变为0
c.电流计读数一直不变d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_____(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为_______,电流计指针向_____(填“左”、“右”)偏转。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:______________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率(选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率,通入Ar,则反应速率。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g)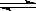 2C(g)+2D(g)
2C(g)+2D(g)
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为;
(2)反应前A的物质的量浓度是;
(3)平衡后,生成物D的浓度为;