海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下: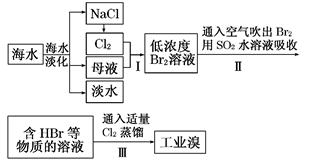
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为____________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
________________________________________________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图: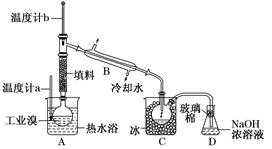
请你参与分析讨论:
①图中仪器B的名称________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件________________________________________________________________________。
甲、乙两池的电极材料都是铁棒与碳棒(如下图).请回答下列问题: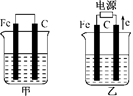
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒.
②在乙池中阴极的电极反应式是________________.
(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式____________________.
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________.
③若乙池转移0.02 mol电子后停止实验,池中溶液的体积是200 mL,则溶液混匀后的pH=________.
工业上处理含Cr2O72—的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.试回答:
(1)电解时的电极反应:阳极________________,阴极__________________________.
(2)Cr2O72—转变成Cr3+的离子反应方程式:_____________________.
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?
______________________________________.
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由______________________.
.短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为______;Z的核外电子排布式是_______。
(2)D的最高价氧化物与E的一种氧化物为等电子体,写出E的氧化物的化学式。
(3)D和Y形成的化合物,其分子的空间构型为____________;D原子的轨道杂化方式是____________。X与Z构成的分子是________分子(填“极性”或“非极性”)
(4)写出一个验证Y与Z的非金属性强弱的离子反应方程式___________。
(5)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是__________________________________________。
.短周期元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定Y元素在周期表中的位置________________________________。
(2)写出X的质量分数为60%的化合物的化学式__________;该分子中中心原子以sp2杂化,是________分子,分子构型________。
(3)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其分子式________、________,并比较酸性强弱:________________。
.有A、B、C、D、E五种短周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式为:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号)。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。