电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。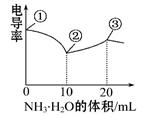
下列说法正确的是
| A.①溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl—)>c(CH3COO—) |
| D.③点后因离子数目减少使电导率略降低 |
现在为婴儿特制的一种新型的尿布——“尿不湿”。这是尿布表面涂有一种既能吸水又能保留水的物质。据你的推测,这种特殊物质的结构可能是( )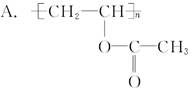
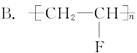
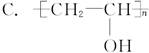
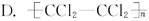
下列单体在一定条件下能发生加聚反应生成 的是( )
的是( )
A.CH3CH==CH2和CH4
C.CH3CH==CH2和CH2==CH2
a mol  和b mol CH2==CH—CN加聚形成高聚物A,A
和b mol CH2==CH—CN加聚形成高聚物A,A
在适量氧气中恰好完全燃烧,生成CO2、H2O(g)、N2,在相同条件下,它们的体积比依次为12∶8∶1,则a∶b为( )
| A.1∶1 | B.3∶2 | C.2∶3 | D.1∶2 |
下列叙述内容不正确的是( )
| A.乙烯和聚乙烯性质相同 |
B.聚乙烯是由 分子组成的化合物,加热至某一温度则可完全熔化 分子组成的化合物,加热至某一温度则可完全熔化 |
| C.同质量的乙烯和聚乙烯完全燃烧后生成的CO2的质量相等 |
| D.乙烯和聚乙烯的实验式相同 |
今有高聚物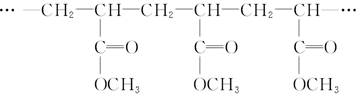
对此分析正确的是( )
| A.它是一种体型高分子化合物 |
B.其单体是CH2==CH2和 |
C.其链节是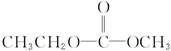 |
D.其单体是 |