亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:(提示 : 无色气体B遇空气显红棕色)
(1)甲方案②中常用 做指示剂。若需配制80 mL0.001 mol·L-1的Na2S2O3标准溶液。现给出下列仪器(配制过程中可能用到):①50 mL烧杯②胶头滴管③天平④80 mL容量瓶⑤100 mL容量瓶⑥玻璃棒,按使用仪器的先后顺序排列正确的是
| A.③①⑤⑥② | B.③①⑥④② | C.③①⑥⑤② | D.③①④⑥② |
请写出配制Na2S2O3标准溶液时定容的操作
(2)已知酸性条件下MnO4—被还原为Mn2+,请写出乙方案①的离子方程式
(3)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性KMnO4溶液(过量)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至溶液紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中 NaNO2的质量为_______mg.
(4)若乙方案②中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,则会导致测定出的NaNO2含量 (填“偏高”、“偏低”或“不影响”)
(5)小组经过讨论,认为 方案更佳,原因是 。
(原创)铜及其化合物在工农业生产中都有着广泛应用。
(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2。当有1molCu生成,则第一个反应中转移电子 mol。
(2)某种处理火法炼铜中SO2废气的工艺流程如下图所示。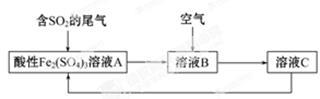
①溶液A中发生的反应为 。
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为 。
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O。则
①反应中的x= 。
②反应产物R的化学式为 。
③参加反应的Cu和消耗的HNO3物质的量之比为 。
下图是化学实验中常用的几种装置。
请回答下列问题: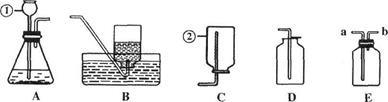
(1)指出有编号的仪器名称:① ,② 。
(2)利用上述A、D装置的组合可以制取的一种气体是 ,写出实验室制取该气体的化学反应方程式 。
(3)若用E装置收集该气体,则气体应从 (选“a”或“b”)导入;若用E装置干燥生成的气体,E中盛放的液体试剂是 。
(4)在实验室如使用碳酸钠与稀盐酸、选用A装置制二氧化碳,需要对A装置进行的改进是 。
如图所示:A、B、C、D是初中化学中常见的不同类别的物质,已知A、B是空气中的两种气体,“ ”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题:
”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题: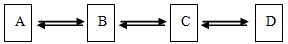
(1)B转化为A的过程叫 ;
(2)B物质的一种用途是 ;
(3)C物质所属的类别是 ;
(4)D转化为C的反应方程式是 。
如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。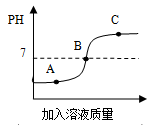
(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。
如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:

(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。