NaHCO3是重要的化工原料,在实验室里可通过下列两个步骤得到:
已知一些物质在20℃、30℃时溶解度数据:
 溶解度(g) 溶解度(g)温度(℃) |
NH4Cl |
NH4HCO3 |
NaHCO3 |
NaCl |
Na2CO3 |
(NH4)2CO3 |
| 20 |
28.7 |
21.7 |
9.6 |
31.5 |
21.5 |
100 |
| 30 |
41.1 |
27.0 |
11.1 |
36.3 |
39.7 |
>100 |
请回答:
(1)步骤Ⅰ反应的化学方程式是 。
(2)若将NH3和CO2两种气体通入顺序互换后没有沉淀,原因是 。
(3)步骤Ⅱ所得白色沉淀中一定有NaHCO3,原因是 。
(4)步骤Ⅱ生成NaHCO3的离子方程式是 。
(5)根据气体物质溶解性及上列溶解度数据,简述上述两过程在较低温度下进行时效果更好的原因 。
下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。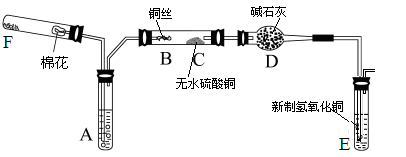
(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)___。
(2)B处发生的化学反应方程式为________________。
(3)C处应出现的现象是_________________,
D处使用碱石灰的作用是__________________,
E处应出现的实验现象是 _____________________,
F处可以添加的固体药品是 ______________。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由此推断此时B处发生反应的化学方程式为______________。
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数:
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是。
(2)反应①和②分别在装置和中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____,优点是用量少,缺点是__________。
(4)反应②为_____(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是。
(5)中和釜D中加入的Z最适宜的是(填编号)
a.NaOHb.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为和,判断的依据是。
(7)用该方法合成苯酚和丙酮的优点是。
海水中含有丰富的化学元素,如图是某化工厂利用海水生产镁的流程简图,
请回答:
(1)实验室中蒸发浓缩液体需要的仪器有玻璃棒、酒精灯、三角架和。
(2)反应③需加入的试剂为。
(3)反应④中能量主要的转化形式为。
(4)步骤②在母液中加入B完全反应后,还需进行的操作是。
(5)若该化工厂由MgCl2生产金属镁的产率是75%,则生产800Kg金属镁至少需要MgCl2的质量为Kg(保留一位小数)。
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为________________
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律: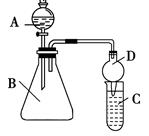
(3)仪器B的名称为________,干燥管D的作用为____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_________________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶除去。
某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2 mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 |
F.生成淡黄色沉淀 |
请帮助该同学整理并完成实验报告。
(1)实验目的:______________________。
(2)实验用品:______________________。
(3)实验内容:
| 实验方案 (填序号) |
实验现象 (填序号) |
有关化学方程式 |
(4)实验结论:_____________________。
(5)请用物质结构理论简单说明具有上述结论的原因___________________