氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C =2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41 g |
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断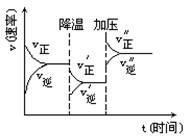
A.降温后逆反应速率增大
B.逆反应是放热反应
C.若A、B是气体,则D是液体或固体
D.A、B、C、D均为气体
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成n mol A2,同时生成n mol AB |
| B.容器内总压强不随时间改变 |
| C.任何时间内A2、B2的物质的量之比为定值 |
| D.单位时间内生成2n mol AB同时生成n mol B2 |
已知热化学方程式:
H2O(g) = H2(g) +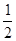 O2(g)△H =" +241.8" kJ·mol-1
O2(g)△H =" +241.8" kJ·mol-1
H2(g)+ 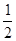 O2(g) = H2O(1)△H = -285.8 kJ·mol-1
O2(g) = H2O(1)△H = -285.8 kJ·mol-1
当18g液态水变为水蒸气时,其热量变化是
| A.吸热44 k J | B.吸热88kJ | C.放热44kJ | D.吸热2.44 kJ |
对于反应A(g)+2B(g)  2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
分别向1 L 0.5 mol·L-1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是
| A.ΔH1>ΔH2>ΔH3 |
| B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1>ΔH2=ΔH3 |
| D.ΔH1=ΔH2<ΔH3 |