铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
①完成下列表格
②实验2比实验1能够较快看到以上现象的原因是 。
右下图为制取乙酸乙酯的实验装置图。回答下列问题: 
揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。
(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。
某化学兴趣小组在实验室在利用废铜屑(含碳粉、铁屑、铁锈等)制取硫酸铜,实验流程如下:
⑴废铜屑灼烧的目的是 。
⑵写出加入双氧水时发生反应的离子方程式 。
⑶试剂a可以是 ,溶液pH应控制在 范围之间。操作b的名称是 。已知:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.5 |
14 |
| Fe3+ |
1.4 |
3.7 |
| Cu2+ |
6.0 |
13 |
⑷在硫酸铜溶液中,各种离子浓度由大到小的顺序是 。向硫酸铜溶液中加入氨水,当Cu2+浓度小于2.2×10-4 mol·L-1时,溶液的pH至少是 。(已知Cu(OH)2的溶度积常数Ksp=2.2×10-20)
⑸工业上通常用FeS除去废水中的Cu2+,写出该沉淀转化离子方程式 。
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。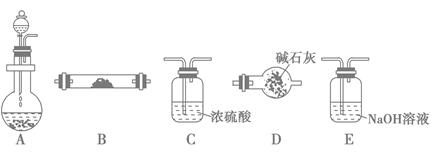
(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。此实验的目的是______ ,
D装置的作用是________ 。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)_________ 。
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:
①用产生的气体做氨的催化氧化实验,各装置按气流方向从左到右的连接顺序是(填字母)___ _____→E。
②试管B中的反应方程式为______ 。
催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: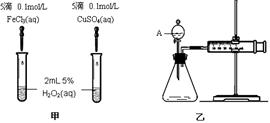
(1)定性分析:如图甲可通过观察,定性比较得出结论。同学乙观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是____________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。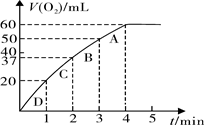
①实验时放出气体的总体积是mL。
②放出1/3气体所需时间为 min。
③计算H2O2的初始物质的量浓度______。(请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>___> ____。
⑤解释反应速率变化的原因。