A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>C>B>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
下列有关有机化合物结构和性质的叙述,正确的是()
| A.乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
| B.C8H10含苯环的烃的同分异构体有3种 |
C.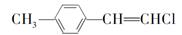 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 |
D.莽草酸(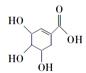 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
下列说法正确的是
| A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol |
| B.标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA |
| C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ |
| D.在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为 |
2CaCO3 +O2+2SO22CaSO3 +2CO2
下列说法正确的是()
| A.用高氯酸与碳酸钙反应制取二氧化碳可证明氯元素非金属性大于碳元素 |
| B.糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| C.硅单质在电子工业上应用广泛,可做光导纤维 |
| D.石油的裂化产生气体、植物油以及苯甲酸均能使酸性高锰酸钾溶液褪色 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.原子半径:W>Z>Y>X>M |
| B.YZ2溶于水形成的溶液具有较强的氧化性 |
| C.1molWM溶于足量水中完全反应共转移2mol电子 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
有机物A的分子式为C5H12O2,则符合下列条件的有机化合物A有(不考虑立体异构)( )
①1 mol A可与金属钠反应放出1 mol氢气 ②含2个甲基 ③1个碳原子上不能连接2个羟基
| A.7种 | B.6种 | C.5种 | D.4种 |