下列实验现象预测正确的是
| A.实验I:振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中无明显现象 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。 若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
以下物质;(1) 甲烷;(2) 苯;(3) 聚乙烯;(4) 聚乙炔;(5) 2-丁炔;(6) 环己烷;(7) 邻二甲苯;(8) 苯乙烯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是
| A.(3) (4) (5) (8) | B.(4) (5) (7) (8) |
| C.(4) (5) (8) | D.(3) (4) (5) (7) (8) |
下列关于有机物的说法错误的是
| A.CCl4、苯均可萃取碘水中的碘 |
| B.石油和天然气的主要成分都是碳氢化合物 |
| C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
下列对有机物结构或性质的描述,错误的是
| A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B.乙烷和丙烯的物质的量共1mol,完成燃烧生成3molH2O |
| C.用水可区分苯和溴苯 |
D.右图中有机物的一氯代物有4种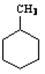 |
图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
| A.a、b不可能是同种材料的电极 |
| B.该装置可能是电解池,电解质溶液为稀盐酸 |
| C.该装置可能是原电池,电解质溶液为稀盐酸 |
| D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸 |