某短周期非金属元素R的原子核外最外层电子数是次外层电子数的一半,有关该元素的下列说法正确的是
| A.在自然界中只以化合态的形式存在 |
| B.RO32-所含电子数比NO3-的电子数多7 |
| C.最高氧化物能与水反应生成含氧酸 |
| D.气态氢化物比CH4稳定 |
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 |
操作 |
现象 |
解释或结论 |
| A |
过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| B |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C |
向某溶液中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 |
试纸变蓝 |
该溶液中存在NH4+ |
| D |
向紫色石蕊试液中通入SO2 |
溶液褪色 |
SO2有漂白性 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: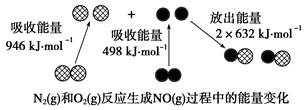
下列说法正确的是()
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下图是元素周期表前四周期的一部分,关于元素R、W、X、Y、Z的叙述正确的是( )
| A.最高价氧化物的水化物的酸性:W>Y |
| B.Z的单质常温下是液体,所在的周期中含有32种元素 |
| C.Z的原子序数比R大17 |
| D.氢化物的沸点:X<Z |
下列条件下化学反应速率最大的是( )
| A.20℃0.1mol·L-1的盐酸溶液20 mL与0.5 g块状碳酸钙反应 |
| B.10℃ 0.1mol·L-1的盐酸溶液20 mL与1 g块状碳酸钙反应 |
| C.10℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
| D.20℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
下列表述正确的是( )
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
| A.①③ | B.①② | C.① | D.①②④⑤ |