Ⅰ、现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为______________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为_________;
Ⅱ、某一元弱酸(用HA表示)在水中的电离方程式是HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是_______________________________________。
(2)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”)。
(6分)(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)= 2H2O(g) ΔH="-483.6" kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH="+67.7" kJ·mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是 。
(2)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
①取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92 kJ(填“大于”“等于”或“小于”),原因是 ;
(1)已知1.505×1023个X气体分子的质量为8 g,则该X气体的物质的量为,其摩尔质量为;
(2)n g O2中有m个O原子,则阿伏加德罗常数NA的数值可表示为
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A;B;C;D;E。
(2)请用离子方程式表示A溶液显碱性的原因。
(3)写出③、④的离子方程式:③;④。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。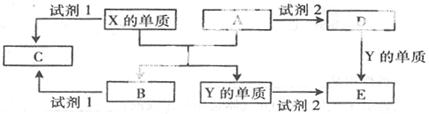
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式________。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O ; 2SO2+SeO2+2H2O→Se+2SO42-+4H+
则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______。
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为___。