我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
| A.均匀分散在水中所形成的分散系属悬浊液 |
| B.分子直径比Na+小 |
| C.均匀分散在水中形成的分散系能产生丁达尔效应 |
| D.“钴酞菁”分子不能透过滤纸 |
根据如图所示的溶解度曲线,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7晶体,需要进行三个操作。这三个操作不包括( )。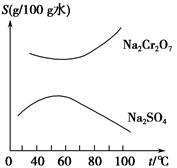
| A.升温结晶 | B.趁热过滤 | C.降温结晶 | D.蒸发结晶 |
下列做法不正确的是( )。
| A.易燃试剂与强氧化性试剂分开放置并远离火源 |
| B.用湿润的红色石蕊试纸检验氨气 |
| C.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液 |
| D.金属钠着火时,用细沙覆盖灭火 |
红斑素、红曲素是常用于糖果、雪糕等食品着色剂的主要成分,结构如下图所示。
下列说法正确的是(双选) ( )。
| A.红斑素和红曲素互为同分异构体 |
| B.红斑素和红曲素都能与NaOH溶液反应 |
| C.红斑素中含有醚键、酯基、羰基等三种含氧官能团 |
| D.1 mol红曲素最多能与6 mol H2发生加成反应 |
绿原酸的结构简式如下图,下列有关绿原酸的说法不正确的是(双选) ( )。
| A.分子式为C16H14O8 |
| B.能与Na2CO3反应 |
| C.能发生取代反应和消去反应 |
| D.0.1 moL绿原酸最多与0.7 mol NaOH反应 |
下列说法正确的是 ( )。
| A.糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| B.苯只能发生取代反应,不能发生加成反应 |
| C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D.溴乙烷与NaOH的乙醇溶液共热生成乙烯 |