氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是利用氮气的一种途径
①步骤I中主要利用N2与液态空气中其它成分的________(填性质)不同。
②最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
(2)氨气可以用于侯氏制碱法,其流程如下图所示: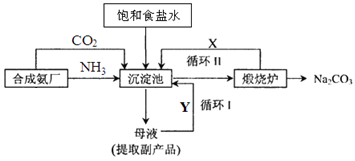
①循环I、II中循环利用的物质X是_________,Y是__________。(填化学式)
②向沉淀池中通入气体时,需要先通入NH3,再通入CO2,其原因是______________。
(共10分)丙烯醇(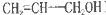 )是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)丙烯醇的分子式为__________;丙烯醇中含有的官能团的名称是__________。
(2)0.3mol丙烯醇与足量金属钠反应,能生成标准状况下的氢气_________ L。
(3)写出丙烯醇与溴水反应的化学方程式____________________________
反应类型为____________________
(4)丙烯醇与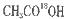 发生酯化反应的化方程式为:________________________________酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化舍物,其结构简式为____________________________。
发生酯化反应的化方程式为:________________________________酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化舍物,其结构简式为____________________________。
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下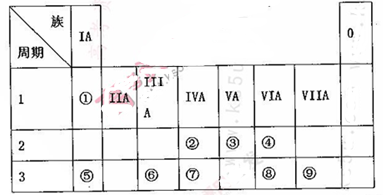
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。试求:
①该有机物的最简式________。
②若符合该最简式的A物质可能不止一种,则它们之间的关系________(填序号)
A.一定互为同系物B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发生酯化反应,且所有碳原子在同一链上,则A的结构简式为________。
巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
(1)化合物F的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)在上述转化过程中,反应②的目的是________,写出反应②的化学方程式为________。(3)下列说法正确的是________(双选,填字母)。
A.化合物A ~ F均属于芳香烃衍生物
B.反应①属于还原反应
C.1 mol 化合物D可以跟4 mol H2发生反应
D.化合物F含有的官能团名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式为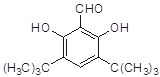 ,请写出另外一种同分异构体的结构简式________。
,请写出另外一种同分异构体的结构简式________。
A.属于芳香族化合物;
B.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
C.1mol该物质最多可消耗2molNaOH
D.能发生银镜反应。
化学式为C5H12O的有机物,可与金属钠反应产生氢气,试根据下列性质按要求填空。
(1)若该有机物可去氢被氧化成羰基化合物,而不能发生脱水消去反应,则该有机物可能氧化生成的羰基化合物的结构简式为。名称
(2)若该有机物不能去氢被氧化成羰基化合物,而能发生脱水消去反应,则该有机物的结构简式可能为。名称